
-

生物通官微
陪你抓住生命科技
跳动的脉搏
刘涛研究团队在《JACS》上发文报道蛋白磷酸化研究的新技术
【字体: 大 中 小 】 时间:2021年12月08日 来源:北京大学药学院 | 分子与细胞药理学系
编辑推荐:
2018年9月25日,美国化学会Journal of the American Chemical Society(JACS)期刊在线刊登了我院刘涛研究员团队的最新研究成果:“Proteomic identification of protein tyrosine phosphatase and substrate interactions in living mammalian cells by genetic encoding of irreversible enzyme inhibitors”。
酪氨酸磷酸化修饰是常见的蛋白翻译后修饰方式之一,在细胞信号转导中起着重要作用,当该修饰发生异常时,则会导致相关疾病的产生。酪氨酸磷酸化修饰具有可逆性,由蛋白酪氨酸激酶(Protein Tyrosine Kinases,简称PTKs)负责添加磷酸基团,由蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphatases,简称PTPs)催化去掉磷酸基团。迄今为止,研究者们广泛地研究PTKs催化机理以及其在相关疾病诱发中的作用,目前已经有20多种基于PTKs的药物在临床上应用。相比之下,虽然有个别PTP的抑制剂在临床研究阶段,由于研究技术的瓶颈,对PTPs功能的阐述以及其与底物相互作用的研究仍然处于初级阶段。
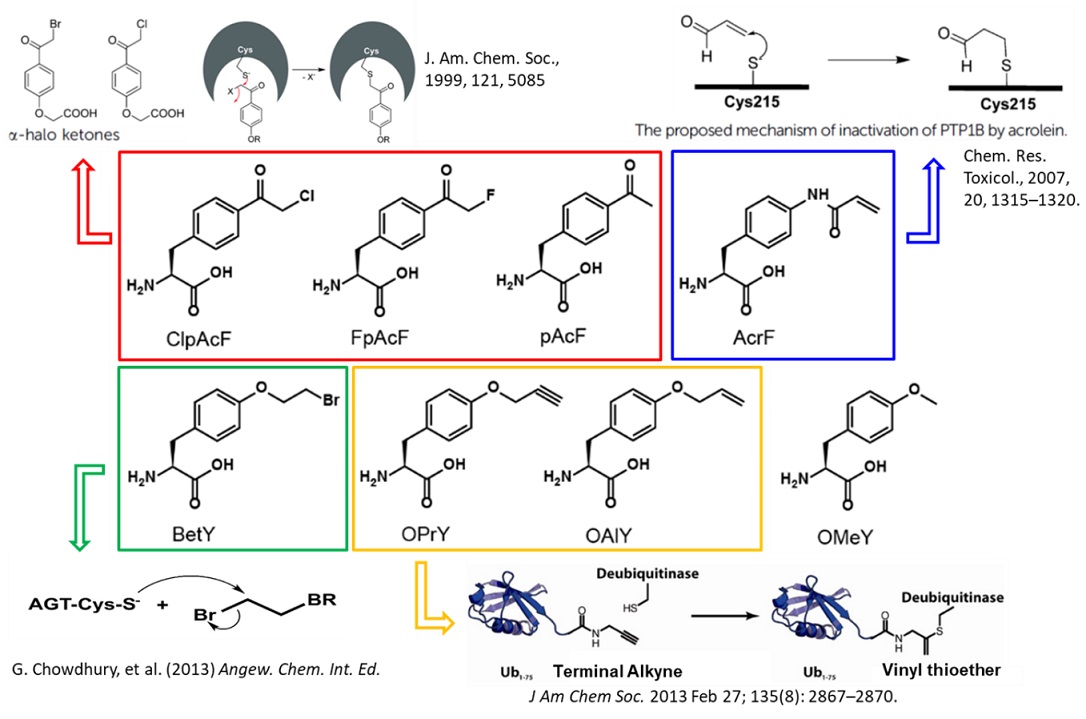
图1 非天然氨基酸靶头的设计
近日,刘涛研究员团队结合了基因密码子扩展技术和蛋白组学分析,开发了简单有效的PTP研究技术。基于PTPs共价抑制剂的作用机制,设计合成了一系列具有反应活性的酪氨酸类似物(图1),即非天然氨基酸(noncanonical amino acids,简称ncAAs),通过基因密码子扩展技术定点编码到底物蛋白上,再根据磷酸酶对底物蛋白的识别和亲和性,拉近其活性位点上的半胱氨酸和底物蛋白磷酸化位点上的非天然氨基酸的距离,从而产生共价交联反应形成复合物。将共价复合物进行分离和蛋白质组学鉴定分析,获得催化底物蛋白特定位点的PTPs(图2)。该研究以原癌基因人类表皮生长因子受体2(Human Epidermal growth factor Receptor 2,HER2)的磷酸化位点Y1221为例,利用此方法发现了磷酸酶PTP1B (Protein Tyrosine Phosphatase 1B)特异催化HER2 1221位点的去磷酸化,这也是首次报道PTP1B与HER2的直接相互作用。该技术为PTPs的研究奠定了基础,对绘制PTPs信号通路以及相关疾病的药物研发具有重要的意义。
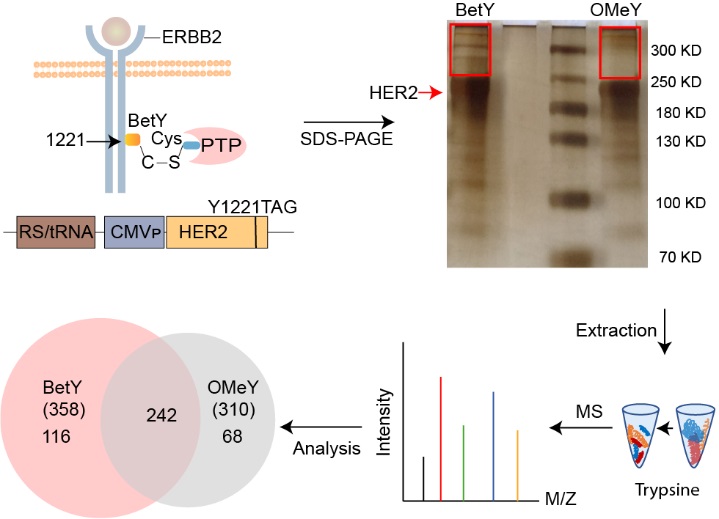
图2 底物特异性磷酸化酶的鉴定
刘涛研究员为本研究论文的通讯作者,北京大学化学院王初研究员为合作团队。刘涛团队的博士后汤红婷和博士研究生戴震为论文的共同第一作者,北京大学天然药物及仿生药物国家重点实验室为第一责任通讯单位。该工作获得了北京大学****,国家自然科学基金(21778005)、国家重点研发计划项目(No. 2016YFA0201400)以及北京大学医学部的资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.8b06922
刘涛研究员简介

刘涛研究员,生于1982年。博士,博士生导师,天然药物及仿生药物国家重点实验室独立PI,北京大学药学院特聘研究员。北京大学****。发表科研论文20余篇,其中以第一作者或者通讯作者的身份在J. Am. Chem. Soc., Cell Chem. Biol., PNAS, Angew. Chem. Int. Ed., J. Med. Chem., ACS Chem. Biol.等一系列杂志上发表高水平论文14篇,申请国际专利两项。团队研究方向以蛋白大分子生物工程,化学修饰以及细胞的信号转导研究为主。研究团队运用化学生物学,合成生物学和转化医学的研究方法,以遗传密码子扩展技术和分子文库筛选技术为核心,突破大自然中蛋白质是由20种天然氨基酸所组成的局限,并将其应用到蛋白大分子制药和阐明疾病的发生发展机理领域,为生物药物的升级换代和开发新的治疗靶点奠定基础。