
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脊髓星形胶质细胞MeCP2调节Kir4.1离子通道在神经病理性疼痛慢性化中机制
【字体: 大 中 小 】 时间:2023年04月04日 来源:四川大学华西医院
编辑推荐:
2023年3月16日,我院麻醉手术中心朱涛教授和周诚研究员合作在Progress in Neurobiology 杂志(IF:10.885)发表研究论文Spinal astrocytic MeCP2 regulates Kir4.1 for the maintenance of chron...
2023年3月16日,我院麻醉手术中心朱涛教授和周诚研究员合作在Progress in Neurobiology 杂志(IF:10.885)发表研究论文Spinal astrocytic MeCP2 regulates Kir4.1 for the maintenance of chronic hyperalgesia in neuropathic pain。该研究联合运用转基因小鼠、RNA干扰、电生理膜片钳、单细胞测序等技术,证明了脊髓星形胶质细胞的MeCP2通过调节Kir4.1离子通道表达,是神经病理性疼痛慢性化和星形胶质细胞活化的关键机制。

我院麻醉手术中心欧梦婵副研究员、陈雅丽助理研究员为论文共同第一作者;我院麻醉手术中心朱涛教授和周诚研究员为通讯作者。
研究者在小鼠建立慢性神经病理性疼痛模型(CCI),发现在CCI急性期后小鼠对应腰段脊髓星形胶质细胞的Kir4.1离子通道表达显著下降;通过在发生了慢性神经病理性疼痛的小鼠脊髓过表达Kir4.1离子通道后,发现其能发挥疼痛治疗作用。进一步对CCI后第14天的小鼠腰段脊髓行单细胞测序发现,星形胶质细胞的Kcnj10基因(编码Kir4.1)和MeCP2基因表达均下降(图1)。
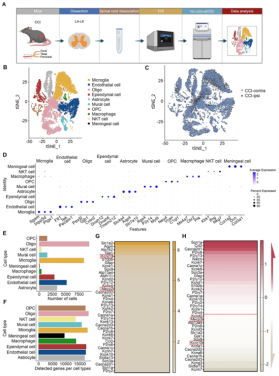
图1. 单细胞测序检测CCI后第14天星形胶质细胞基因表达变化。
随后研究者利用条件性基因敲除和脊髓病毒注射等方法特异性降低小鼠脊髓星形胶质细胞的Kir4.1表达,证实了疼痛的发生。并采用Kir4.1-siRNA特异性下调小鼠脊髓中Kir4.1后,对脊髓切片进行膜片钳记录,证实了脊髓的Kir4.1表达下降能够去极化星形胶质细胞的膜电位从而活化星形胶质细胞,进而调控脊髓背角神经元静息膜电位、改变其放电模式维持Tonic放电,介导痛觉超敏发生(图2)。
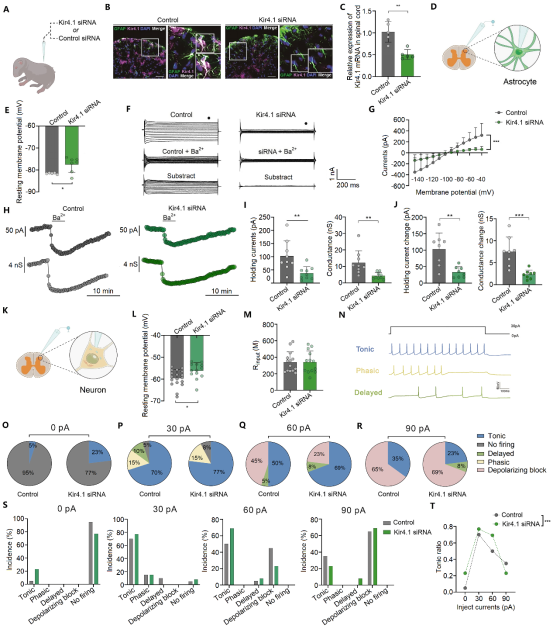
图2. 敲低脊髓的Kir4.1离子通道 对星形胶质细胞和神经元电生理功能的影响。
最后,研究者特异性分别敲低脊髓神经元和星形胶质细胞的MeCP2,发现只敲低脊髓神经元的MeCP2对小鼠痛阈和Kir4.1表达无显著影响;而特异性敲低脊髓星形胶质细胞的MeCP2,能够调控Kir4.1的表达并改变小鼠的痛阈。
该研究工作的主要创新点包括:1. 首次在脊髓背角水平证实了Kir4.1离子通道的表达是慢性神经病理性疼痛发生的重要机制,通过提高脊髓Kir4.1的表达和功能可能对慢性神经病理性疼痛具有良好的治疗作用。2. 首次通过电生理记录技术探明了脊髓背角星形胶质细胞在疼痛发生中调控神经元电活动的神经生物学机制。3. 首次在神经病理性疼痛模型中发现,星形胶质细胞的MeCP2是调控Kir4.1表达的重要分子靶点。
该项研究工作得到国家重点研发计划、国家自然科学基金、四川省卫生健康委员会基金、和美国国立卫生研究院的经费支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S0301008223000369?via%3Dihub
 生物通微信公众号
生物通微信公众号
知名企业招聘