
-

生物通官微
陪你抓住生命科技
跳动的脉搏
神经外科徐建国教授团队在Science Advances发文:造釉细胞型颅咽管瘤单细胞测序揭示肿瘤异质性及肿瘤微环境特征
【字体: 大 中 小 】 时间:2023年04月19日 来源:四川大学华西医院
编辑推荐:
2023年4月12日,我院神经外科徐建国教授、胸部肿瘤研究所陈耀辉特聘研究员团队与香港大学张高研究团队合作在Science Advances(IF:14.980)在线发表了题为Single-cell RNA sequencing highlights intratumor heteroge...
2023年4月12日,我院神经外科徐建国教授、胸部肿瘤研究所陈耀辉特聘研究员团队与香港大学张高研究团队合作在Science Advances(IF:14.980)在线发表了题为Single-cell RNA sequencing highlights intratumor heterogeneity and intercellular network featured in adamantinomatous craniopharyngioma的研究论文。该研究首次以单细胞分辨率揭示了造釉细胞型颅咽管瘤(ACP)异质性景观,系统性地构建了ACP肿瘤细胞和组织微环境的细胞图谱,并进一步阐明了各细胞簇之间的信号通讯网络,为改进ACP临床精准医疗方案和靶向药物研发提供了科学依据。

造釉细胞型颅咽管瘤(adamantinomatous craniopharyngiomas, ACPs)是一种好发于鞍区的罕见颅内肿瘤,起源于退化残余的颅咽管上皮(也被称为Rathke囊)。流行病学数据表明ACP患者的年龄呈现出两极分布的态势,主要集中在5-14岁的儿童和50-74岁的成人。作为在儿童时期最常见的累及下丘脑-垂体轴的病变,ACP对患者的生长发育和内分泌稳态造成了灾难性的损害。在肿瘤与脑组织交界处,肿瘤上皮形成“指状突起”并侵袭下丘脑周围重要神经结构,造成广泛的神经系统损伤和预后不良。手术是ACP主要的一线治疗方式。然而,考虑到肿瘤侵略性的生物学行为以及肿瘤与垂体柄、视交叉,尤其是下丘脑位置的密切关系,全切手术极具挑战性并常导致严重的神经功能损伤。
既往的研究支持ACP具有复杂的组织学结构,然而其细胞组成和功能特征尚不清楚,因而阻碍了对其肿瘤发生机制的深入探索。在先前的报道中,组织病理学分析显示ACP内部主要由栅栏样结构、螺纹小体、湿角蛋白结节(wet keratin)和星型网状组织组成。这种组织学结构的多样性可能导致细胞功能的显著差异。ACP通常被认为是由CTNNB1 exon3突变驱动的(如S37F)。CTNNB1激活突变可以阻止其编码蛋白β-catenin的正常降解,导致其在细胞核中积累并诱导WNT通路的持续活化。然而,早期通过病理学观察发现β-catenin仅在零星的肿瘤细胞中出现细胞核聚集现象,而大多数肿瘤细胞均表现为β-catenin的细胞膜定位,暗示了ACP肿瘤细胞具有复杂的肿瘤异质性。此外,目前ACP临床前研究中针对β-catenin的靶向治疗策略一直未能取得满意的效果,提示多种因素参与了肿瘤发生和进展过程。
为了解析ACP肿瘤异质性特征,研究者对ACP肿瘤组织进行了单细胞测序并表征了肿瘤微环境内主要的细胞类型,包括肿瘤上皮细胞、免疫细胞和神经胶质细胞。随后在对肿瘤细胞的下游分析中,研究者揭示了四种主要的基因表达特征(meta-signature),并且对其各自标志物的multi-IHC染色显示了它们独特的空间位置分布。根据表达谱和组织学定位,研究者将肿瘤细胞定义为四种cell-states,即①角质样上皮(keratinized-like epithelium,KE);②螺纹样上皮(whorl-like epithelium,WE);③循环细胞(cycling cell,CC);④栅栏样上皮(palisade-like epithelium,PE)。其中PE主要沿肿瘤组织最外侧分布,呈栅栏状紧密排列并与外侧的间质组织直接接触。PE中的肿瘤细胞高表达基因参与应激刺激的早期反应,这可能与神经胶质瘢痕组织广泛存在的炎症环境有关。另外两种肿瘤细胞KE和WE主要分布在肿瘤栅栏样上皮层的内侧。WE主要分布在指状突起内的螺旋小体结构中,其特征主要是β-catenin核积累和WNT通路的持续激活。KE表达独特的角蛋白谱,如细胞角蛋白KRT6、KRT7、KRT13和毛囊角蛋白KRT75,提示它们可能代表了上皮发育阶段较为成熟的肿瘤细胞簇。CC作为增殖状态的细胞则主要分布在栅栏样上皮层,而极少分布于其他肿瘤区域。研究者在额外18个ACP患者队列中验证了分型标准的普适性,表明这些细胞状态可能反映了ACP在肿瘤发育过程中的基本特征。为了深入了解不同肿瘤细胞的生物学功能差异,研究者还进行了GSVA和SCENIC分析。其中,WNT通路在WE中被富集,而转录因子分析提示β-catenin、LEF1和TCF4仅在WE中被特异性激活,这与组织病理学中的结论相互佐证,提示了CTNNB1 exon3突变可能并不是ACP肿瘤中WNT信号激活的充分条件。
先前的研究认为具有WNT通路激活样特征的WE驱动了ACP肿瘤发生和进展。然而,不同于经典的肿瘤生发中心,WE缺乏活跃的增殖能力并表现出衰老的迹象。研究者进一步探究了ACP的肿瘤发育问题。转录组剪接动力学和伪时间分析的结果揭示了ACP肿瘤细胞可能起始于PE,并遵循两个不同的分化方向,其中一种向WE细胞状态进化,伴随着WNT信号通路逐渐激活;而另一种则向KE方向分化,伴随着更显著的上皮发育特征。此外,研究者还观察到一组WE特有的拷贝数变异(CNV)积累模式,这可能与WE衰老状态下基因组不稳定性的增加有关。尽管如此,通过构建细胞间通讯网络揭示了WE作为肿瘤内的“分泌中枢”分泌多种细胞因子,如WNT5A、WNT10A、FGF4、FGF8、BMP2、BMP4和SHH,这些细胞因子参与肿瘤内WNT信号的调控。这些迹象表明,WE可能倾向于作为功能核心,在ACP肿瘤进展中起关键作用。
ACP侵袭脑组织的过程诱导肿瘤外胶质细胞增生并形成胶质瘢痕,后者构成了肿瘤与脑组织之间的缓冲区,同时也代表了ACP特有的TME特征。研究者发现相对于正常脑组织,肿瘤相关星形胶质细胞表达了更高水平的GFAP。此外,肿瘤组织来源的星形胶质细胞触角变粗,相邻细胞的GFAP+胶质纤维相互重叠、交叉、缠结形成胶质瘢痕,这些现象是星形胶质细胞活化的特征。随后,研究者报道了一种具有免疫表型的少突胶质细胞谱系(immunophenotypic oligodendrocyte lineage cells,iOLs),其特异分布于TME中并表达抗原呈递相关标志物(如HLA-DRA,CD74,PSMB8等)。先前的研究在自身免疫性疾病模型中报道了这种特殊表型的少突胶质细胞,如多发性硬化和实验性自身免疫性脊髓炎。ACP肿瘤内较高的IFN-γ表达水平可能为iOLs的功能转化提供了条件。由于CD8+ T细胞能够识别iOLs并发挥细胞毒性作用,因此这种功能转化可能加重了肿瘤浸润过程中的神经损伤并阻碍神经髓鞘修复。同时,相对于自身免疫性疾病模型,来自ACP TME的iOLs具有更多独特的生物学功能。例如在ACP中,iOLs接受来自肿瘤细胞的FGF2-FGFR信号的调节迁移到TME中并表达一系列蛋白聚糖,参与肿瘤ECM微环境的重塑。
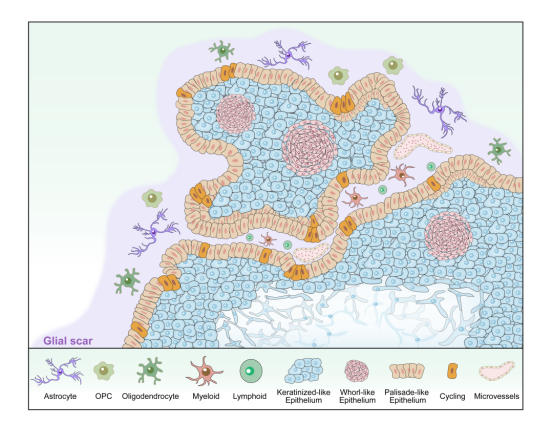
ACP肿瘤组织异质性景观
该研究基于单细胞RNA测序就造釉细胞型颅咽管瘤肿瘤细胞分子分型、肿瘤细胞发育,以及慢性炎症环境下胶质瘢痕与肿瘤之间的信号串扰等方面进行了深入探讨;首次以单细胞分辨率揭示了ACP肿瘤异质性景观,系统性地构建了ACP肿瘤细胞和组织微环境的细胞图谱,并进一步阐明了各细胞簇之间的信号通讯网络。该研究不仅总结了驱动ACP肿瘤发生与进展的细胞生物学基础和重要分子靶点,而且为改进ACP临床精准医疗方案和靶向药物研发提供了科学依据。
我院徐建国教授、陈耀辉特聘研究员和香港大学张高副教授为该研究的共同通讯作者。我院神经外科江宇硕士、杨金龙博士、梁锐超助理研究员和昝昕主治医师为共同第一作者。徐建国教授团队长期致力于神经系统肿瘤,尤其是颅底肿瘤(颅咽管瘤、脑膜瘤、垂体瘤等)的临床诊疗和基础研究工作;陈耀辉特聘研究员课题组长期致力于肿瘤衰老和免疫逃逸机制研究。