
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Cell Death & Disease:线粒体Ca2+超载介导AIFM1突变相关听神经病的机制
【字体: 大 中 小 】 时间:2023年07月06日 来源:浙江大学生命科学学院
编辑推荐:
2023 年 6 月 26 日,浙江大学严庆丰 / 张冬 教授 团队与 中国人民解放军总医院王秋菊 教授团队联合 在 Cell Death & Disease 在线发表题为“ Impaired AIF-CHCHD4 interaction and mitochondrial calcium overload contribute to auditory neuropathy spectrum disorder in patient-iPSC-derived neurons with AIFM1 variant” 的研究论文, 阐明 AIF 突变抑制 CHCHD4 催化的 MICU1-MICU2 异二聚体形成, 引起 线粒体 Ca 2+ 超载, 导致 细胞凋亡 ,及 听神经病发生 的机制, 为听神经病的诊断 及干预治疗提供了新思路
听神经病(ANSD)是一类较多见的听觉障碍疾病,约占儿童永久性听力丧失的15%,主要由内毛细胞、螺旋神经节神经元和/或听神经本身功能不良所致,多在婴幼儿和青少年时期发病。听神经病的遗传因素多样,包括导致突触前膜病变相关基因、突触后膜病变相关基因、螺旋神经节和上行听神经病变相关基因、以及突触和听神经均发生病变的相关基因等。AIFM1基因编码凋亡诱导因子(AIF),锚定于线粒体内膜,受凋亡刺激时,转移至细胞核诱导细胞凋亡。然而,AIFM1基因突变与听神经病之间的相关性及其致病机制尚不清楚。
严庆丰教授团队长期从事聋病的遗传和分子机制,以及疾病特异性诱导多能干细胞(iPSCs)的基础和转化等研究。iPSCs具有供体细胞来源丰富、可大量扩增并定向分化为各种功能细胞等优点。源于患者体细胞的疾病iPSCs在重编程和定向分化过程中保持致病基因不变;基因矫正模型可以克服患者和对照iPSCs之间的遗传背景差异,以及由于年龄或性别等引起的其他变量。疾病特异性iPSCs、基因矫正iPSCs及其分化细胞共同组成了疾病研究的理想细胞模型。
2023年6月26日,浙江大学严庆丰/张冬教授团队与中国人民解放军总医院王秋菊教授团队联合在Cell Death & Disease在线发表题为“Impaired AIF-CHCHD4 interaction and mitochondrial calcium overload contribute to auditory neuropathy spectrum disorder in patient-iPSC-derived neurons with AIFM1 variant”的研究论文,阐明AIF突变抑制CHCHD4 催化的 MICU1-MICU2 异二聚体形成,引起线粒体Ca2+超载,导致细胞凋亡,及听神经病发生的机制,为听神经病的诊断及干预治疗提供了新思路。

研究者在前期报道新的听神经病相关AIFM1c.1265G>A突变的基础上,发现该点突变还会引起一个新的AIFM1 c.1267-1305剪接变异。收集家系患者和正常对照个体的外周血样本,通过非整合型的三质粒转染系统,重编程构建了正常对照iPSCs(Con-iPSCs)、疾病特异性iPSCs(AN-iPSCs);进一步利用CRISPR/Cas9基因编辑技术得到基因矫正iPSCs(CORR-iPSCs)模型。分别将Con-iPSCs、AN-iPSCs和CORR-iPSCs定向分化为听神经元并开展功能研究,发现AIFM1基因突变显著降低了AIF蛋白的二聚体形成,削弱了AIF-CHCHD4的互作,从而导致MICU1-MICU2异二聚体形成减少,触发不受控制的MCU介导的线粒体Ca2+摄入,引起线粒体Ca2+超载。细胞内钙离子诱导的钙蛋白酶活化、AIF单体对钙蛋白酶的敏感性以及线粒体Ca2+超载引起的线粒体通透性转换孔的开放共同促进AIF从线粒体易位至细胞质,招募下游的凋亡相关蛋白转运至细胞核,介导Caspase非依赖的细胞凋亡。

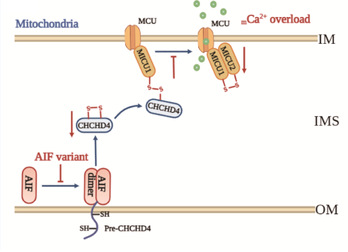
该研究表明,AIFM1突变是听神经病的分子基础之一。线粒体功能障碍,特别是mCa2+超载,在介导AIFM1突变相关听神经病的发生中起着重要作用。该发现初步揭示了听神经病的致病分子机制,为听神经病的干预治疗提供了理论和实验基础。
浙江大学生命科学学院为第一论文单位,浙江大学生命科学学院博士生邱悦、中国人民解放军总医院副主任医师王洪阳为论文共同第一作者。中国人民解放军总医院王秋菊教授、浙江大学生命科学学院严庆丰教授和张冬研究员为论文共同通讯作者。
全文链接:https://doi.org/10.1038/s41419-023-05899-6