
-

生物通官微
陪你抓住生命科技
跳动的脉搏
微生物所王硕研究团队在神经-免疫与肠道稳态调节研究中取得进展
【字体: 大 中 小 】 时间:2023年08月12日 来源:中国科学院微生物研究所
编辑推荐:
近日,中国科学院微生物研究所王硕研究团队在 Journal of Experimental Medicine 期刊发表题为“ FOXO1 orchestrates the intestinal homeostasis via neuronal signaling in group 3 innate lymphoid cells ”的研究论文
近日,中国科学院微生物研究所王硕研究团队在Journal of Experimental Medicine期刊发表题为“FOXO1 orchestrates the intestinal homeostasis via neuronal signaling in group 3 innate lymphoid cells”的研究论文。该研究揭示了转录因子FOXO1通过平衡III型固有淋巴细胞(ILC3)的血管活性肠肽(VIP)和肾上腺素相关的神经信号通路,调节ILC3的活化,进而维持肠道稳态。
肠道固有淋巴细胞(ILC)在抵抗病原体感染、调节炎症和维持屏障完整性等方面发挥重要作用,但对于肠道中的神经信号调节ILC免疫应答的机制还研究甚少,调节ILC等淋巴细胞内神经相关信号通路的关键分子和作用机制仍有待进一步揭示。
本研究发现环磷酸腺苷(Cyclic adenosine monophosphate,cAMP)信号能够抑制ILC3中转录因子FOXO1的蛋白水平,进而加重肠道炎症。研究团队发现在生理或肠道柠檬酸杆菌感染情况下,FOXO1缺失显著激活肠道ILC3, ILC3产生大量IL-17A和IL-17F等炎症因子,进而加重了肠道炎症,且该过程并不依赖T细胞。为了深入了解FOXO1对ILC3和T细胞调控机制的差异,研究人员分离了肠道固有层的ILC3和CD3+ T细胞,经过单细胞转录组测序分析,发现FOXO1可以促进ILC3的血管活性肠肽受体VIPR2的表达,并抑制肾上腺素受体ADRA2A的表达,而这两种受体在T细胞中均不表达。进一步研究发现,饮食相关的VIPR2信号抑制ILC3活化,而应激相关的ADRA2A信号促进ILC3活化并加重肠道炎症。这两种信号通路均受到FOXO1蛋白的调节,FOXO1能够结合Vipr2基因和Adra2a基因的启动子区域,促进Vipr2并抑制Adra2a基因的表达,从而调节ILC3的活化。另一方面,研究团队通过构建慢性束缚应激小鼠模型,发现慢性应激会提高小鼠体内cAMP的水平,进而抑制FOXO1的水平,介导肠道ILC3的过度活化,从而加重肠道炎症。同时,对炎症性肠病(IBD)患者和健康人肠道的活检样本分析,发现IBD患者中ILC3的神经相关通路也受到cAMP-FOXO1轴的调控。本研究揭示了FOXO1通过神经-免疫轴平衡ILC3的活化,进而调节肠道稳态(图1),研究表明禁食和精神压力分别通过抑制VIPR2信号和激活ADRA2A信号导致ILC3过度活化,可能是导致结肠炎的危险因素。
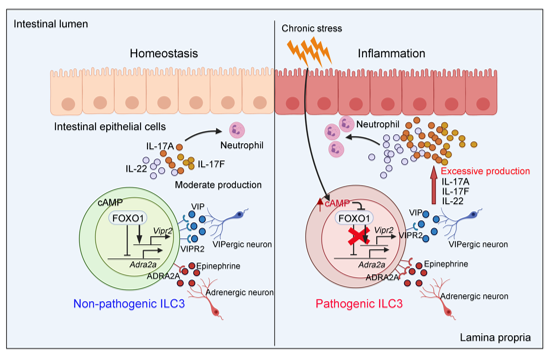
图1. FOXO1通过神经信号调节肠道ILC3功能的作用机制
中国科学院微生物研究所特别研究助理邵菲、博士研究生刘臻和解放军总医院第七医学中心魏青林医生为本文的共同第一作者,中国科学院微生物研究所王硕研究员为本文的通讯作者。本研究得到了国家重点研发计划、国家自然科学基金和中国科学院青年创新促进会等项目的资助。