
-

生物通官微
陪你抓住生命科技
跳动的脉搏
上海科技大学Natue子刊发文,在微型基因编辑器开发与机制研究方面取得进展
【字体: 大 中 小 】 时间:2023年08月24日 来源:国家自然科学基金委员会
编辑推荐:
在国家自然科学基金项目(批准号:22277078、22077083、22207074)资助下,上海科技大学季泉江教授与西湖大学申怀宗教授团队合作在微型基因编辑器的开发与机制研究方面取得新进展,相关成果以“氧化硫酸杆菌微型Cas12f1核酸酶的分子结构与工程进化(Structure and engineering of miniature Acidibacillussulfuroxidans Cas12f1)”为题,于2023年7月31日在《自然·催化》(Nature Catalysis)杂志上发表
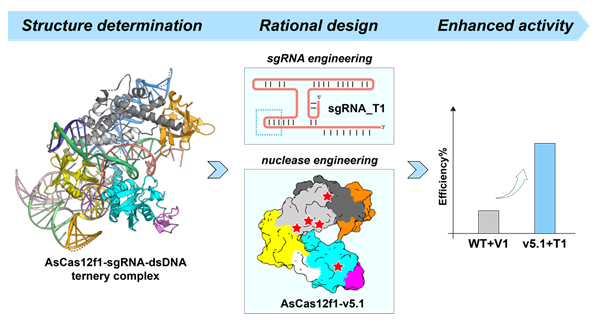 |
图 氧化硫酸杆菌微型Cas12f1核酸酶的分子结构与工程进化示意图 在国家自然科学基金项目(批准号:22277078、22077083、22207074)资助下,上海科技大学季泉江教授与西湖大学申怀宗教授团队合作在微型基因编辑器的开发与机制研究方面取得新进展,相关成果以“氧化硫酸杆菌微型Cas12f1核酸酶的分子结构与工程进化(Structure and engineering of miniature Acidibacillussulfuroxidans Cas12f1)”为题,于2023年7月31日在《自然·催化》(Nature Catalysis)杂志上发表。论文链接:https://www.nature.com/articles/s41929-023-00995-4。 CRISPR-Cas基因编辑技术因其简便性和高效性,被广泛应用于生物医药、农业育种、合成生物学等领域。然而,常用的Cas9与Cas12a核酸酶具有较大的分子尺寸(>1,000个氨基酸),限制了其在基因治疗等方面的应用。2021年,季泉江团队证明了微型基因编辑器-AsCas12f1(含422个氨基酸,分子尺寸为Cas9的1/3)的编辑活性。本研究中,季泉江与申怀宗团队利用冷冻电镜技术解析了AsCas12f1-sgRNA-dsDNA三元复合体的精细分子结构,阐明了AsCas12f1可以形成不对称同源二聚体结构,进一步结合一分子sgRNA(小向导RNA),从而靶向结合于靶DNA序列上。AsCas12f1独特的分子结构决定了它能够以更小的分子尺寸,发挥与大型核酸酶相似的基因编辑功能,其sgRNA中存在的多茎环同轴RNA螺旋结构,为理解Cas核酸酶演化进程中的“蛋白替代RNA”假说提供了新证据。此外,团队还揭示了AsCas12f1自发形成同源二聚体的分子机制、识别原间隔序列临近基序的关键氨基酸残基位点、以及同源二聚体中各个单体核酸酶分子对sgRNA结合、底物识别与切割的具体功能。基于上述结构生物学信息,团队通过sgRNA截短与核酸酶氨基酸残基替换,得到工程改造后的AsCas12f1-v5.1,其在哺乳动物细胞中的基因编辑活性提升了1.5~13.5倍,同时基因脱靶编辑效率显著低于Cas9和Cas12a。该研究开发的小尺寸基因编辑器AsCas12f1-v5.1可满足病毒递送系统对分子尺寸的严苛要求(图)。