
-

生物通官微
陪你抓住生命科技
跳动的脉搏
功能蛋白质组学再登Nature,揭秘胰腺癌的信号传导
【字体: 大 中 小 】 时间:2024年11月14日 来源:南方医科大学
编辑推荐:
胰腺导管腺癌(PDAC)是目前最致命的癌症之一,缺乏早期诊断标志物并且对几乎所有疗法有较高耐药性。PDAC具有非典型、高度间质性的肿瘤微环境。目前研究结果普遍基于大块组织检测,对PDAC的肿瘤微环境的解析能力有限,无法深入解析其细胞异质性。2024年11月13日,南方科技大学田瑞军课题组于Nature上发表了题为”Clinical functional proteomics of intercellular signalling in pancreatic cancer”的最新研究成果。通过使用临床功能蛋白质组学策略,系统性解析了PDAC微环境中癌细胞和基质细胞之间的信号传导。
胰腺导管腺癌(PDAC)是目前最致命的癌症之一,缺乏早期诊断标志物并且对几乎所有疗法有较高耐药性。PDAC具有非典型、高度间质性的肿瘤微环境。目前研究结果普遍基于大块组织检测,对PDAC的肿瘤微环境的解析能力有限,无法深入解析其细胞异质性。2024年11月14日,南方科技大学田瑞军课题组于Nature上发表了题为”Clinical functional proteomics of intercellular signalling in pancreatic cancer”的最新研究成果。通过使用临床功能蛋白质组学策略,系统性解析了PDAC微环境中癌细胞和基质细胞之间的信号传导。

临床功能蛋白质组学通过在时间、空间及信号传导通路上下游等多个维度解析,旨在更好的对疾病微环境中多样化细胞间信号传导网络进行研究,并发现更多关键生物标志物和药物靶点。值得一提的是,早在2019年,南方科技大学田瑞军课题组便在Nature上发表了针对胰腺癌的功能蛋白质组学研究工作,文中发现的关键靶点LIF更是被快速的推进到临床实验中取得了积极成果。2024年发表的研究成果既是对之前研究成果的继承与深化,也是对临床功能蛋白质组学技术的迭代与升级。
主要亮点:
1、开发了一种新的临床功能蛋白质组学策略TMEPro,深入分析PDAC肿瘤微环境中细胞之间的相互作用,识别了癌细胞和基质细胞间的重要信号传导轴。
2、受体膜外域脱落机制为解析PDAC TME中的信号传导提供了新的维度,为新型生物标志物及药物靶点的发现提供了新的方向。
3、TMEPro数据资源为PDAC的诊断标志物和治疗靶点发现提供了宝贵的数据资源,系统构建了一个原位的PDAC TME的细胞间信号传导图谱。
一、细胞间分泌蛋白、膜蛋白图谱构建
由于分泌蛋白、膜蛋白(简称S-PM蛋白)普遍丰度较低且普遍会发生糖基化修饰,作者首先通过肼化学富集的方法对29例肿瘤、27例癌旁(NT)、28例慢性胰腺炎(CP)及16例正常胰腺组织进行了S-PM蛋白富集和深度质谱检测,共鉴定2741个S-PM蛋白和6181个N-糖基化位点,包括80个此前未被报道的N-糖基化蛋白。分泌蛋白及膜蛋白覆盖率均超过人总蛋白组的50%。通过对差异蛋白进行聚类分析,发现大多数蛋白趋于从正常到肿瘤样本,其中肿瘤组织和CP间呈现更高的相似性,并且发现了91个FDA批准的药物靶点及31个已收录的癌症标志物。总之,作者构建了目前最大规模、覆盖最全面的S-PM蛋白组和N-糖基化蛋白组数据集,为研究细胞间信号传导提供了坚实的数据基础。
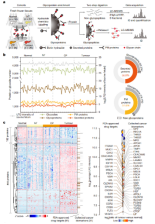
图1. 胰腺癌中高深度S-PM蛋白质组图谱
二、空间和细胞类型特异性蛋白质组
为了进一步解析S-PM蛋白质的细胞来源和潜在的细胞间信号传导功能,作者在13个PDAC肿瘤样本中,通过激光显微切割技术切割了癌细胞(PCC)和基质(stroma)并进行了空间蛋白质组学检测,平均每个样本鉴定超过7000种蛋白质,其中约有1400种S-PM蛋白。为了补充确认S-PM蛋白的细胞来源,作者选取了6株代表性的胰腺癌细胞系及2株stroma主要细胞类型CAF细胞系进行了深度蛋白质组学检测。结合空间蛋白组和细胞系数据,共鉴定到2331个S-PM蛋白,其中癌细胞特异蛋白787个,stroma特异性蛋白584个。通过GO富集分析进一步体现了不同细胞来源的S-PM蛋白功能的特异性,其中ECM通路相关蛋白主要来源于基质细胞,而绝大多数转运体激活相关蛋白则是来源于PCC。由于S-PM蛋白在信号传导具有重要功能,作者对癌和基质细胞的自分泌、旁分泌信号进行了受配体分析,确认了72个癌-基质细胞受配体对和190个基质-癌细胞受配体对。
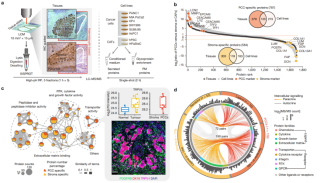
图2. 空间及细胞类型特异性蛋白质组学工作流程及功能分析
三、S-PM蛋白时间维度解析
由于胰腺癌早期难以诊断,因此作者使用胰腺癌经典转基因动物模型KPC小鼠分析了不同时间节点S-PM蛋白的表达情况。与人组织样本处理策略相同,平均每个样品鉴定约1500个S-PM蛋白和3000个N-糖基化位点。基于表达模式聚类分析,可以将这些S-PM蛋白分成三类,其中,529个S-PM蛋白被作者定义为肿瘤进展相关蛋白,包括25个已报道的胰腺癌标志物和57个FDA批准的药物靶点。在此基础上,作者对S-PM蛋白进行了受配体分析发现,在1724个受配体对中,约600个受配体对发生了配体或受体的显著变化,并且发现在晚期阶段中具有更多活跃的信号传导。
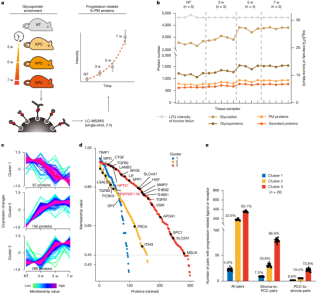
图3. 时间维度的S-PM分析
四、酪氨酸磷酸化介导的信号通路激活
酪氨酸磷酸化(pTyr)通常会激活第一波细胞间的信号传导,具有重要生物学意义。作者使用Photo-pTyr-scaffold和SH2-superbinder两种策略进行深度pTyr蛋白质组学检测,共鉴定464个膜蛋白,包括51个pTyr-writer,91个pTyr reader和46个pTyr eraser,绝大多数在肿瘤组织内表达量有明显上升。利用TMEPro策略中的多维蛋白质组数据,作者聚焦于具有显著变化的“激活”信号轴,尤其是旁分泌PDGF–PDGFR–PTPN11轴。研究表明,肿瘤中PDGFRA和PDGFRB受体显著上调,磷酸化水平增加,主要由癌细胞分泌的PDGFC配体激活。进一步实验验证了癌细胞的PDGF信号可以激活基质细胞中的PDGFR信号通路,尤其是PDGFRA和PTPN11的磷酸化,最终通过PDGFR–PTPN11–ERK–FOS轴促进白血病抑制因子(LIF)的分泌。LIF反向作用于癌细胞,通过激活LIFR–GP130–STAT3通路形成双向信号环路。
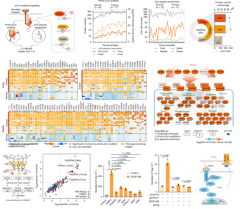
图4. PDAC中酪氨酸磷酸化介导的细胞间信号传导的功能分析
五、膜蛋白剪切机制对信号传导的影响及受体酪氨酸激酶AXL的剪切调控
作者进一步研究了膜蛋白(PM)胞外域剪切对胰腺癌(PDAC)信号传递的影响,尤其是AXL的剪切调控。通过生物信息学分析筛选出22种在PDAC中被剪切的膜蛋白,AXL是其中最显著的。研究显示,基质金属蛋白酶(MMP)家族(特别是MMP1和MMP11)在PDAC肿瘤中的上调可能是AXL剪切的主要调控因子。进一步实验表明,AXL的剪切产物(sAXL)在肿瘤中增加,且在淋巴结转移患者中更为活跃。sAXL通过与配体GAS6结合,阻止GAS6对AXL的激活,削弱AKT等下游信号。阻断AXL的剪切并结合AXL激酶抑制剂R428,显著抑制了胰腺癌细胞增殖和肿瘤生长。该研究揭示了AXL剪切在PDAC中的潜在靶点价值,为精准治疗提供了新方向。
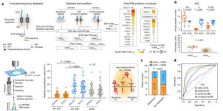
图5. 膜蛋白脱落及AXl剪切机制影响
综上所述,作者通过TMEPro临床功能蛋白质组学策略系统分析了PDAC肿瘤微环境中的细胞间信号网络,揭示了癌细胞和基质细胞间的重要通信机制。研究发现了关键信号轴(如PDGF)和膜蛋白剪切(如AXL剪切)的调控在PDAC进展中的重要作用。此研究不仅深化了对PDAC肿瘤微环境中信号传递的理解,还提供了癌细胞与基质细胞相互作用的新视角,为胰腺癌的诊断与治疗靶点开发提供了新的可能性和资源。
 生物通微信公众号
生物通微信公众号
知名企业招聘