
-

生物通官微
陪你抓住生命科技
跳动的脉搏
神经颗粒素与MYH9互作调控脑血管细胞骨架重塑的新机制及其在阿尔茨海默病中的潜在意义
【字体: 大 中 小 】 时间:2025年10月02日 来源:Fluids and Barriers of the CNS 6.2
编辑推荐:
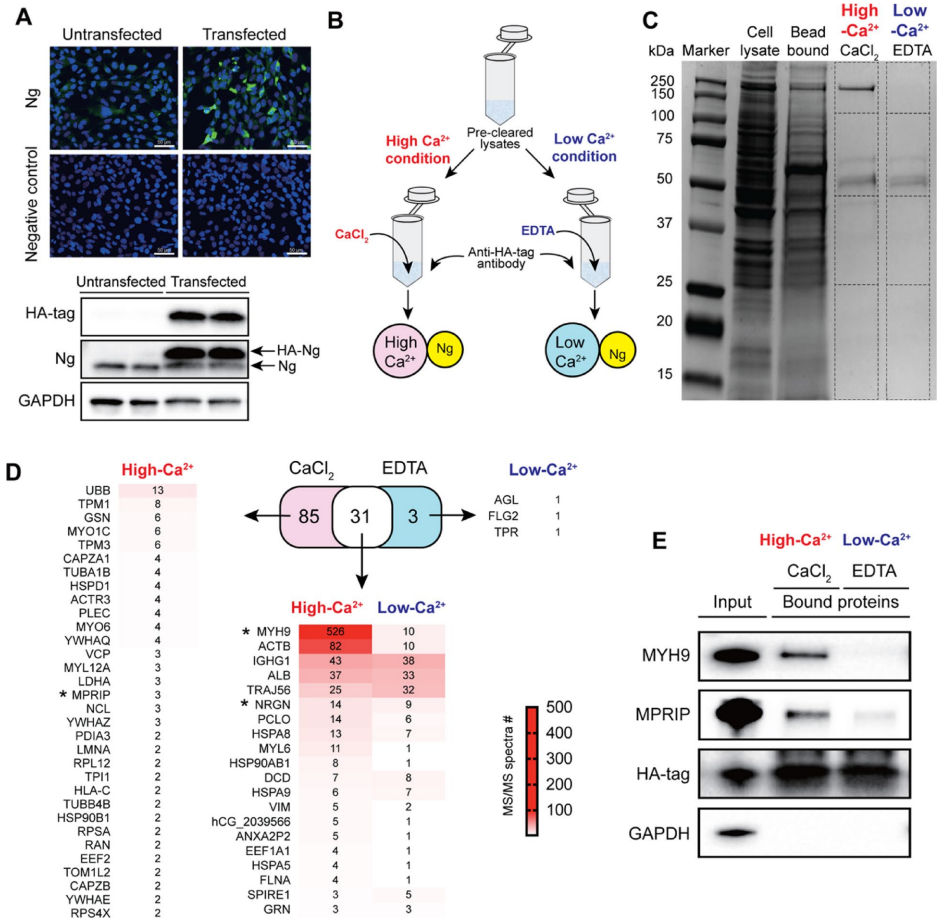
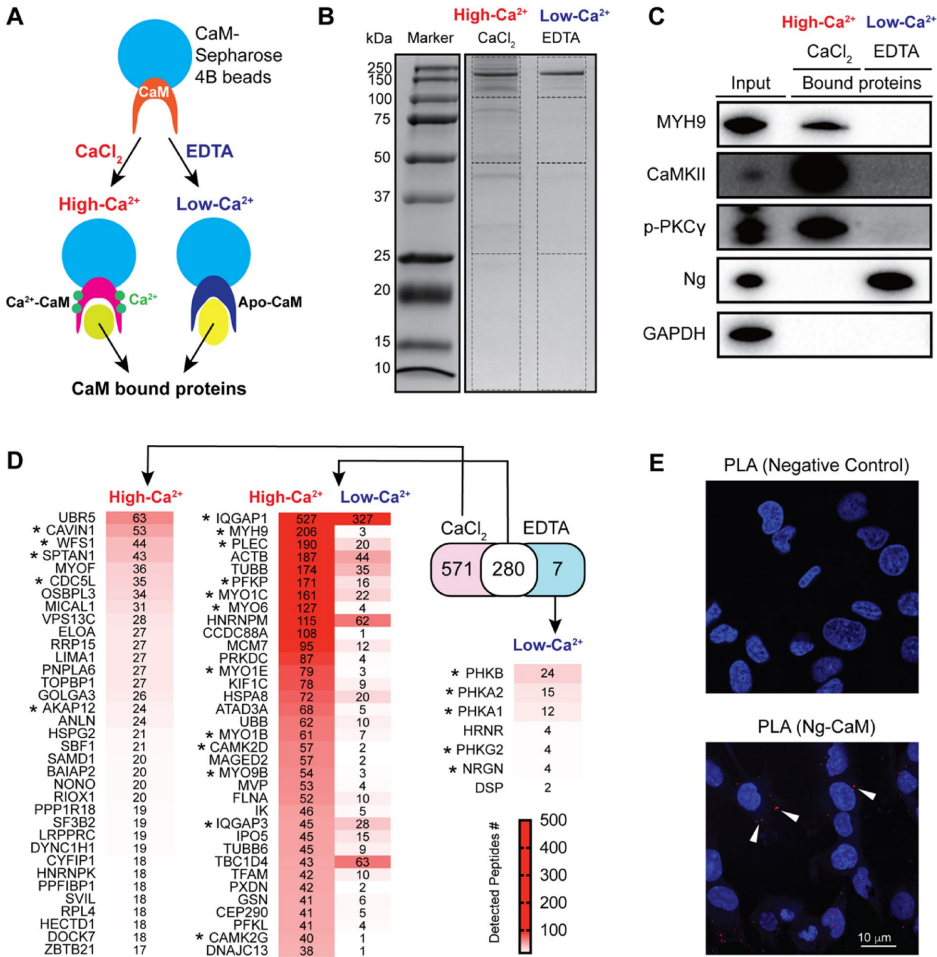
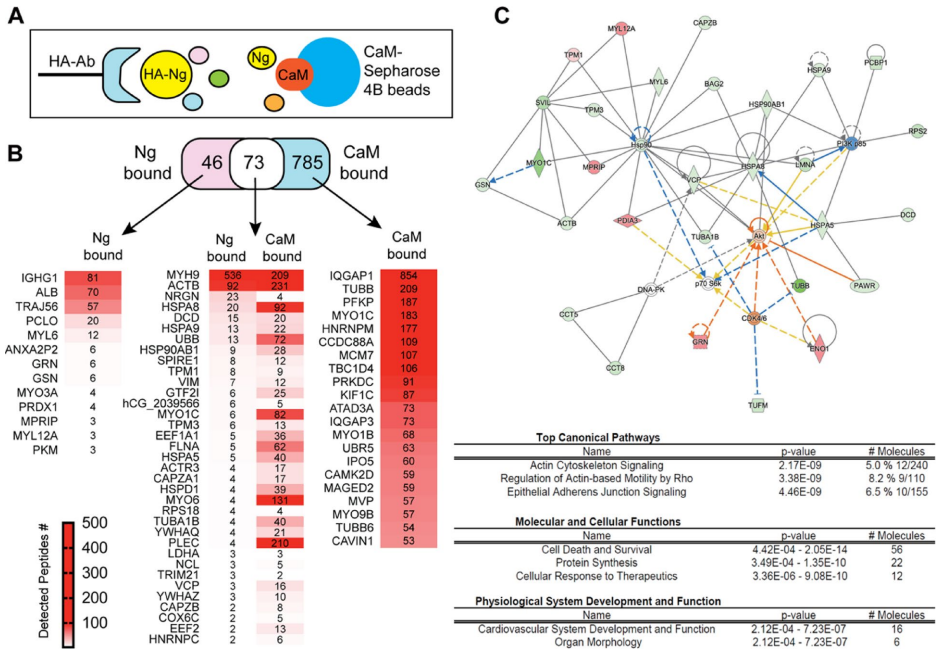
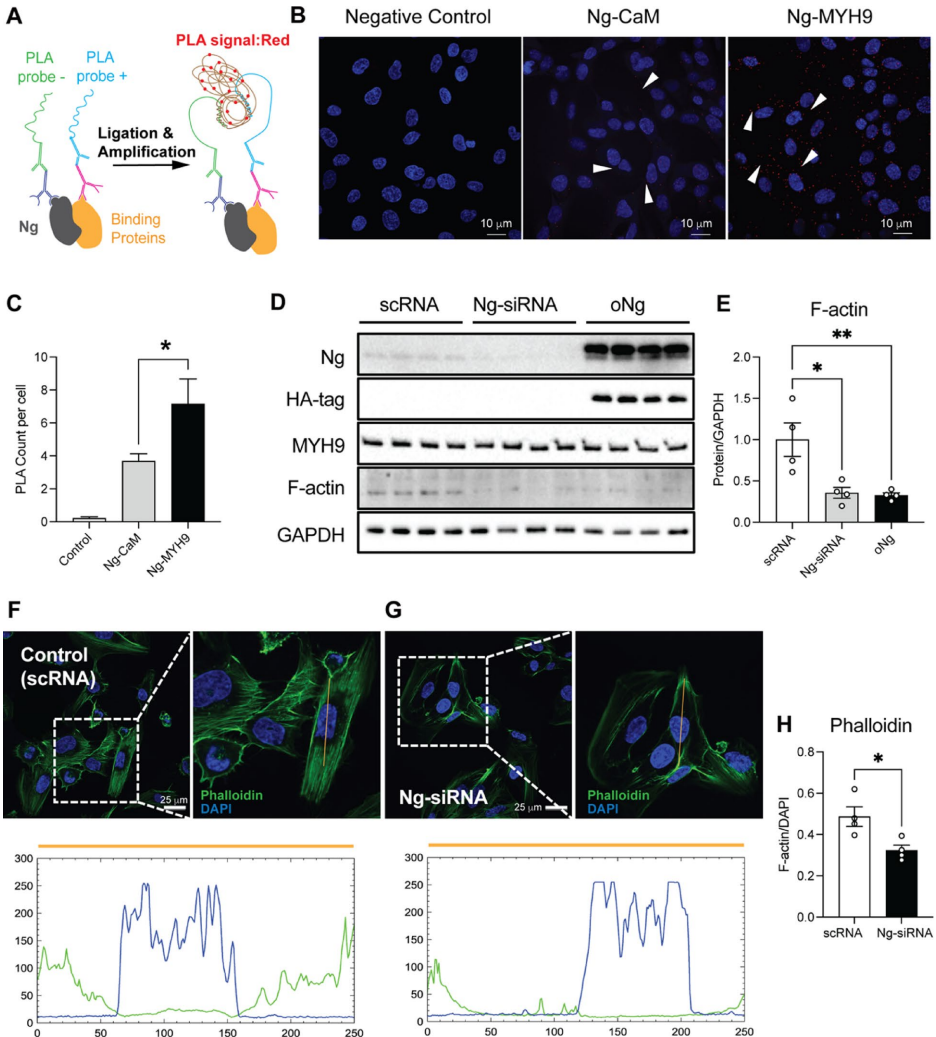
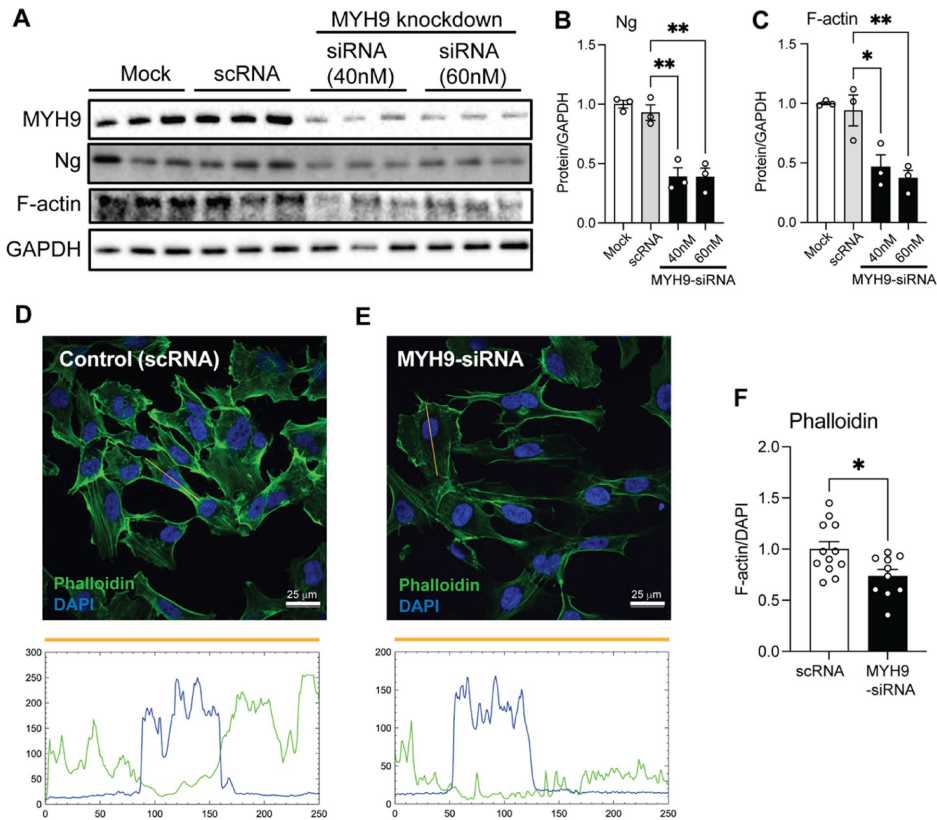
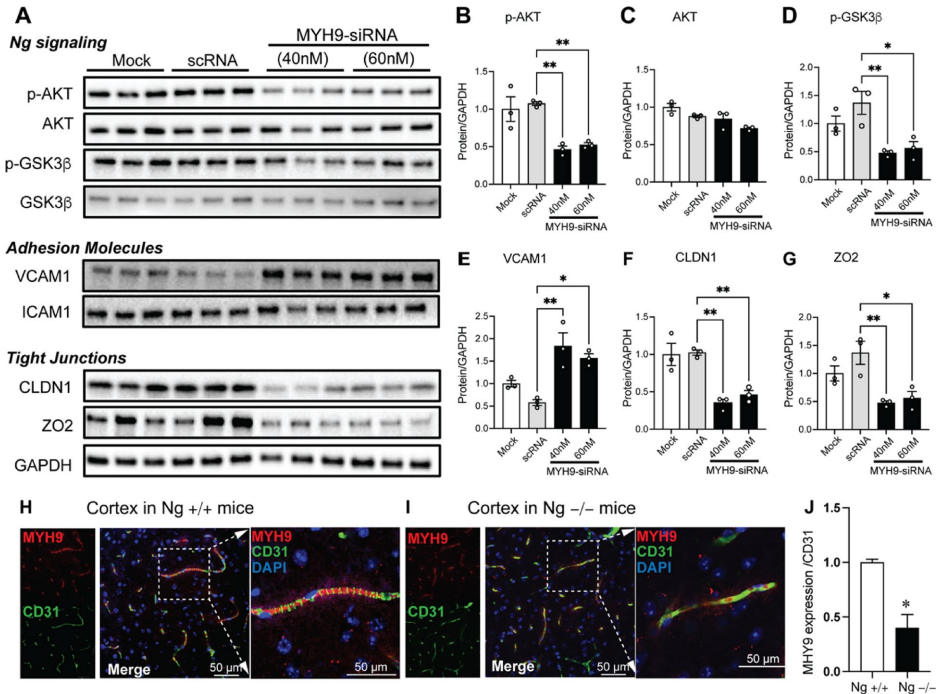
本研究针对神经颗粒素(Ng)在脑血管中的未知功能展开探索。研究人员通过免疫沉淀-质谱联用技术(IP-MS)揭示了Ng与肌球蛋白重链9(MYH9)在脑微血管内皮细胞中的新型钙离子依赖性互作,证实该互作通过调控细胞骨架重塑、影响AKT-GSK3β信号通路及血管内皮激活标志物VCAM1表达,进而参与血脑屏障完整性维持。Ng基因敲除小鼠模型进一步验证了Ng缺失导致脑血管结构紊乱及MYH9表达下调。该研究为阿尔茨海默病等神经系统疾病的血管病理机制提供了新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘