
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:生物材料与细胞疗法在脊髓损伤后的应用
【字体: 大 中 小 】 时间:2025年10月03日 来源:Journal of Translational Medicine 7.5
编辑推荐:
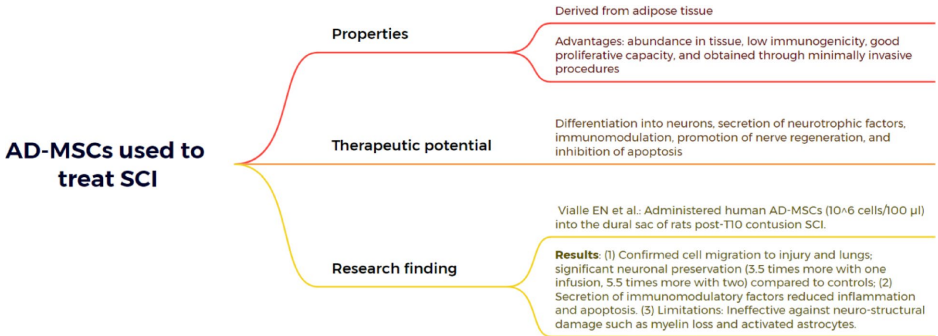
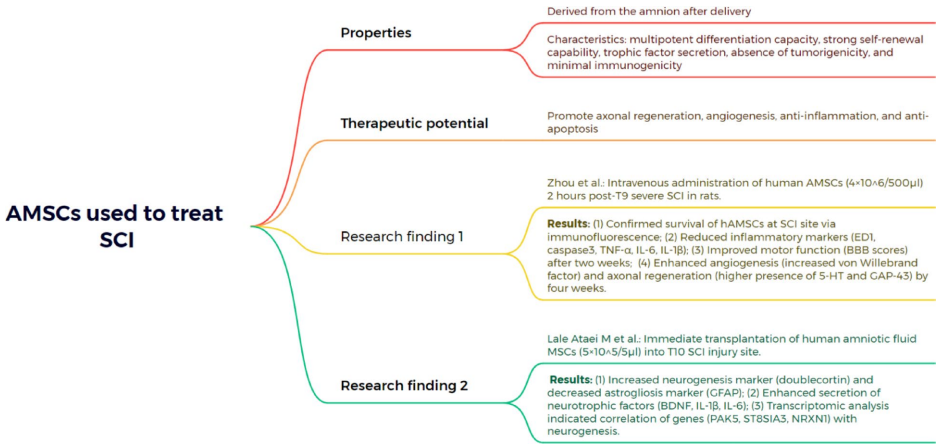
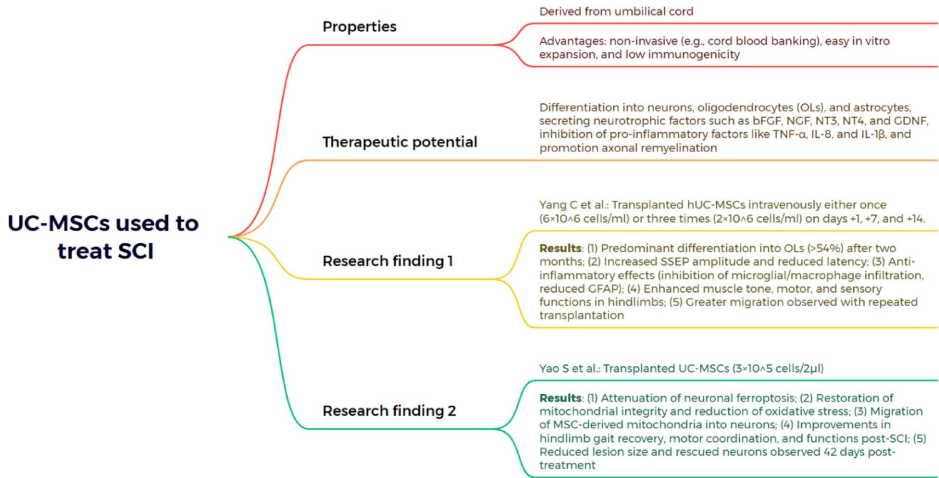
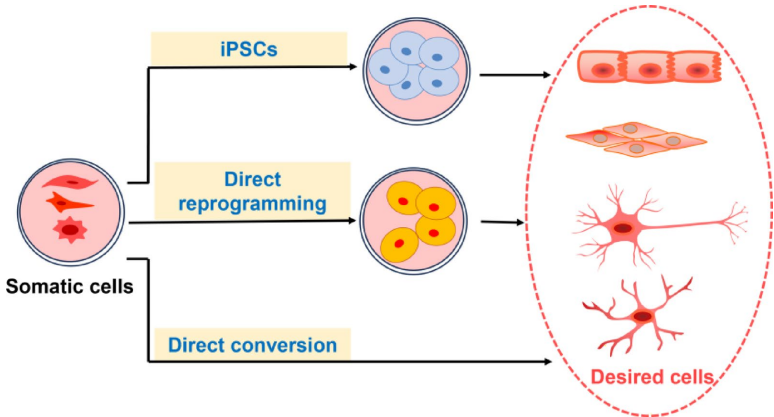
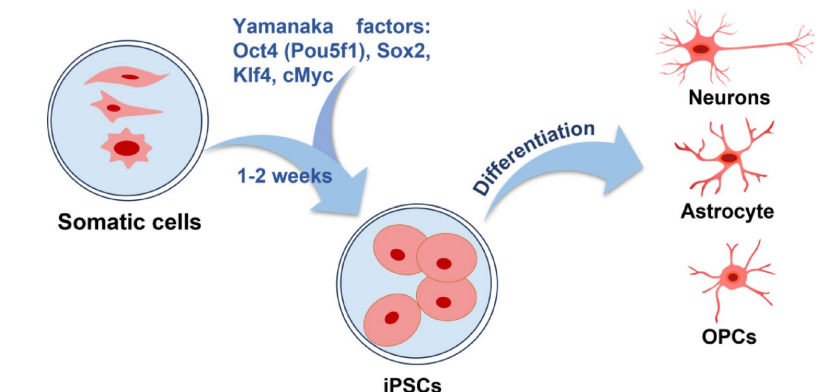
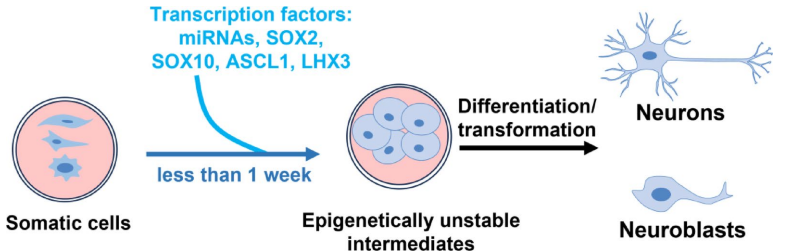
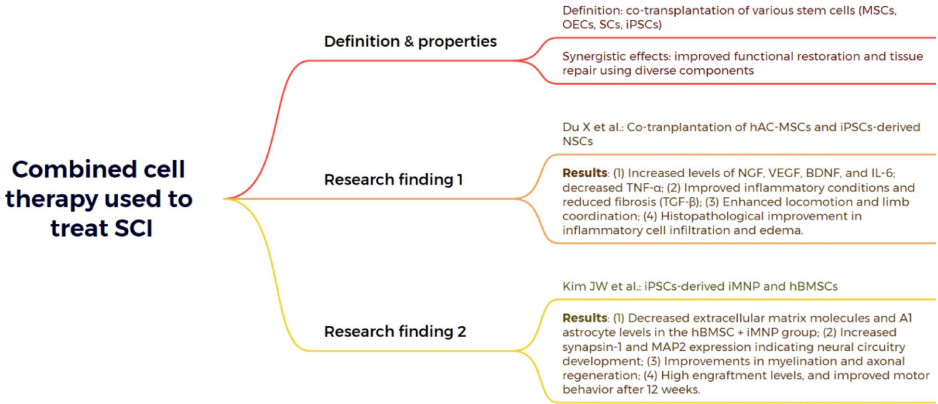
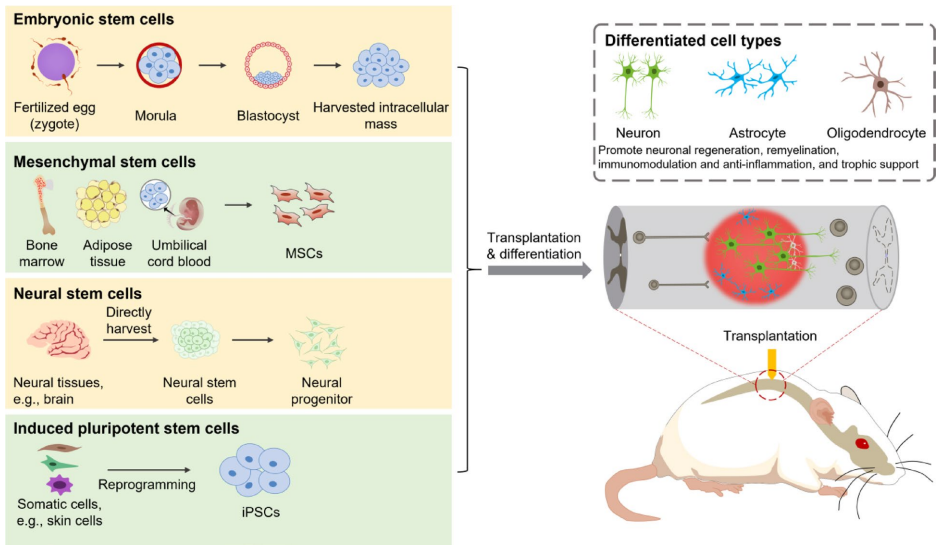
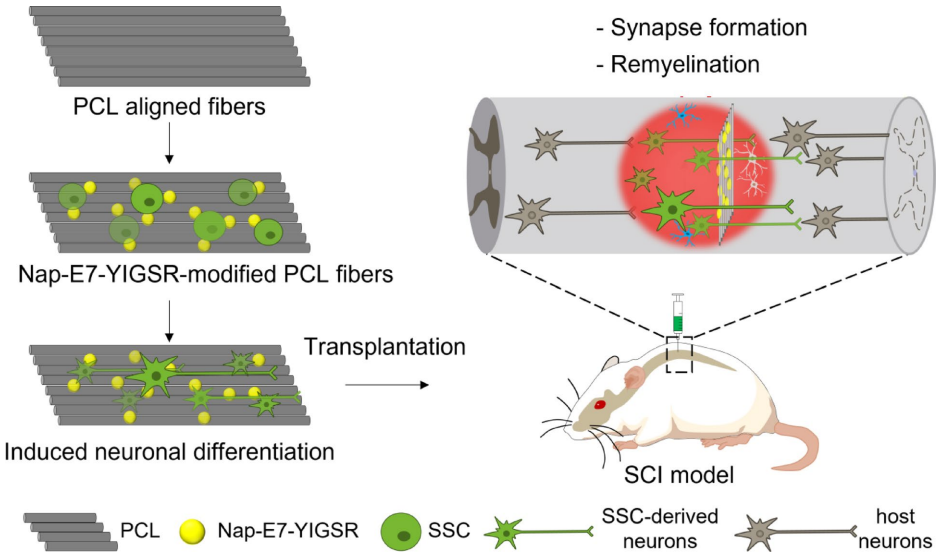
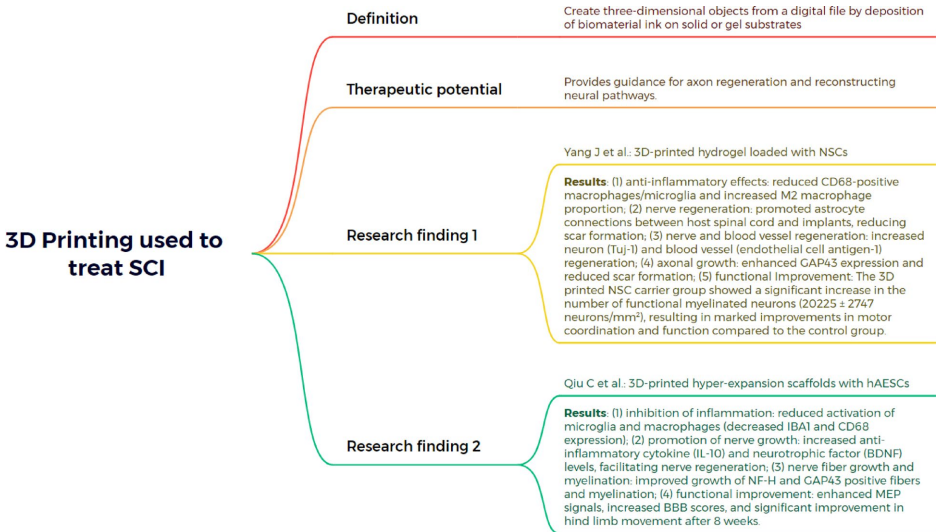
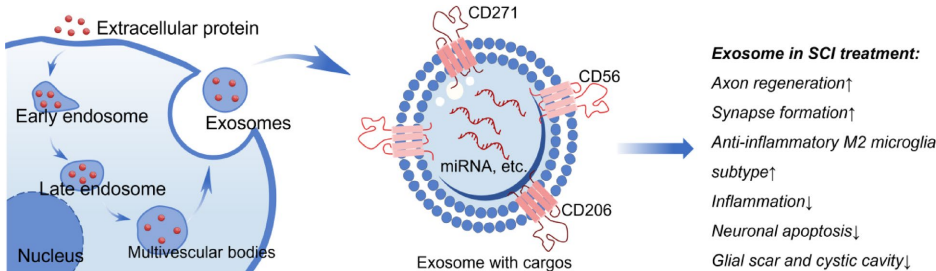
本综述系统阐述了脊髓损伤(SCI)后生物材料与细胞治疗的最新进展,涵盖胚胎干细胞(ESCs)、间充质干细胞(MSCs)、神经干细胞(NSCs)、少突胶质祖细胞(OPCs)、雪旺细胞(SCs)及嗅鞘细胞(OECs)等多种细胞疗法的机制与应用,并探讨了水凝胶、胶原支架、聚己内酯纤维及3D打印等生物材料在提供支持支架、促进神经元再生和减少胶质瘢痕方面的协同治疗策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘