
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脑脊液神经元五聚蛋白通过小胶质细胞-星形胶质细胞信号通路介导阿尔茨海默病tau病理机制研究
【字体: 大 中 小 】 时间:2025年10月04日 来源:Journal of Neuroinflammation 10.1
编辑推荐:
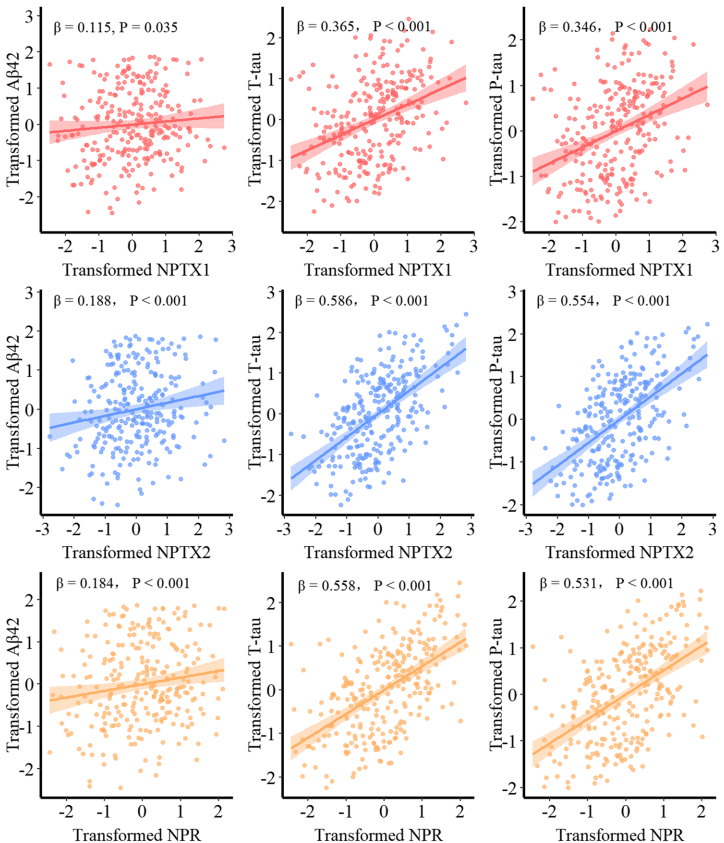
本研究针对神经元五聚蛋白(NPTX)家族在阿尔茨海默病(AD)病理进展中的作用机制不明确的问题,通过分析ADNI队列263名参与者的多维度数据,首次发现脑脊液NPTX蛋白水平与tau病理(T-tau/P-tau)呈显著正相关,且该关联受小胶质细胞标记物sTREM2和星形胶质细胞标记物GFAP的序列介导。研究揭示了NPTX通过调控神经免疫交互作用影响tau磷酸化的新机制,为AD的早期诊断和靶向治疗提供了新型生物标志物和干预策略。



 生物通微信公众号
生物通微信公众号
知名企业招聘