
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:脂质重编程与铁死亡在肾透明细胞癌中的相互作用:代谢脆弱性与治疗靶向
【字体: 大 中 小 】 时间:2025年10月04日 来源:Molecular Cancer 33.9
编辑推荐:
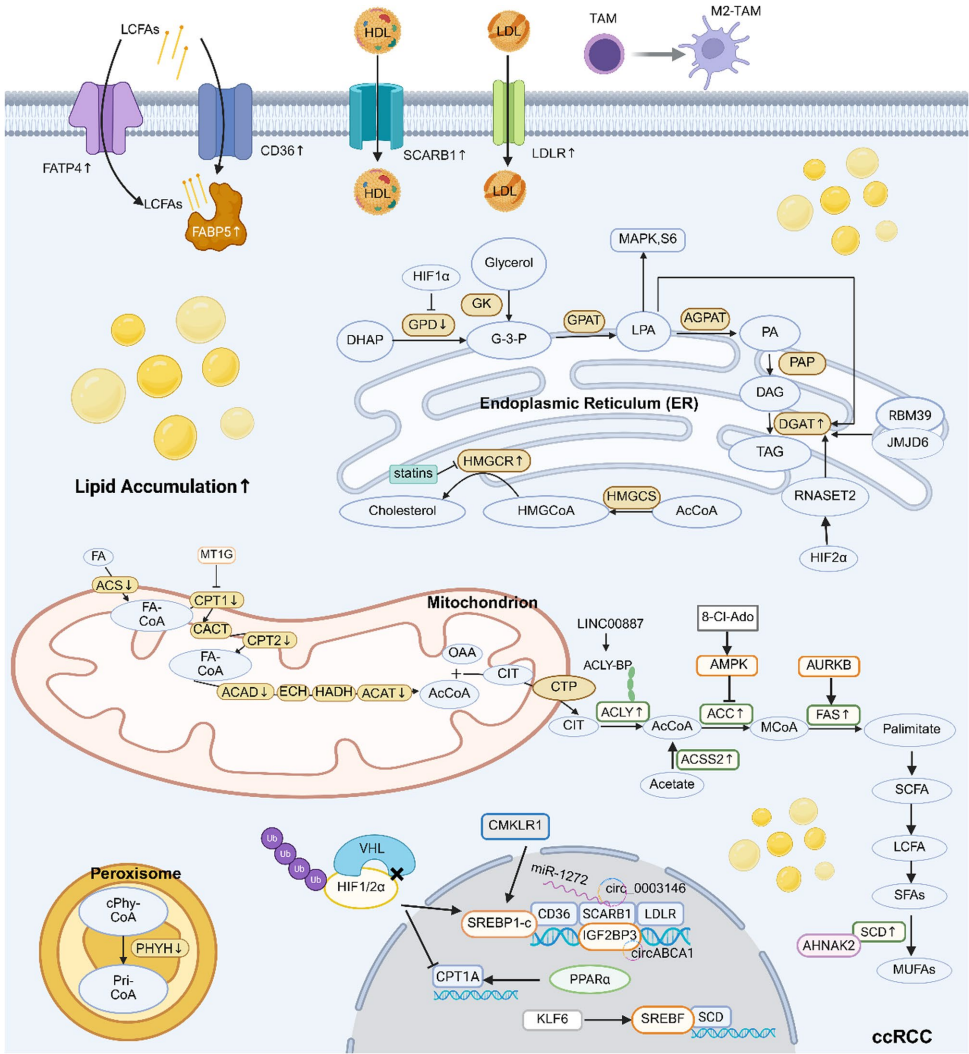
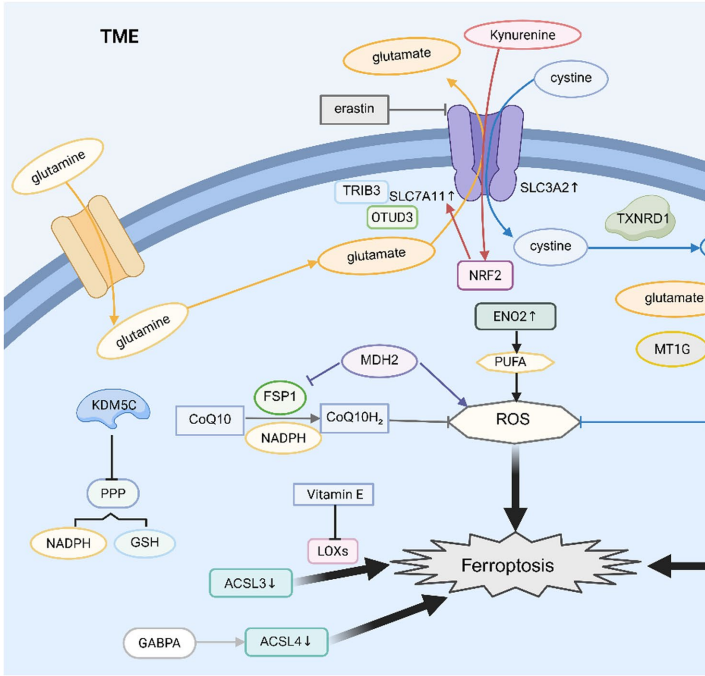
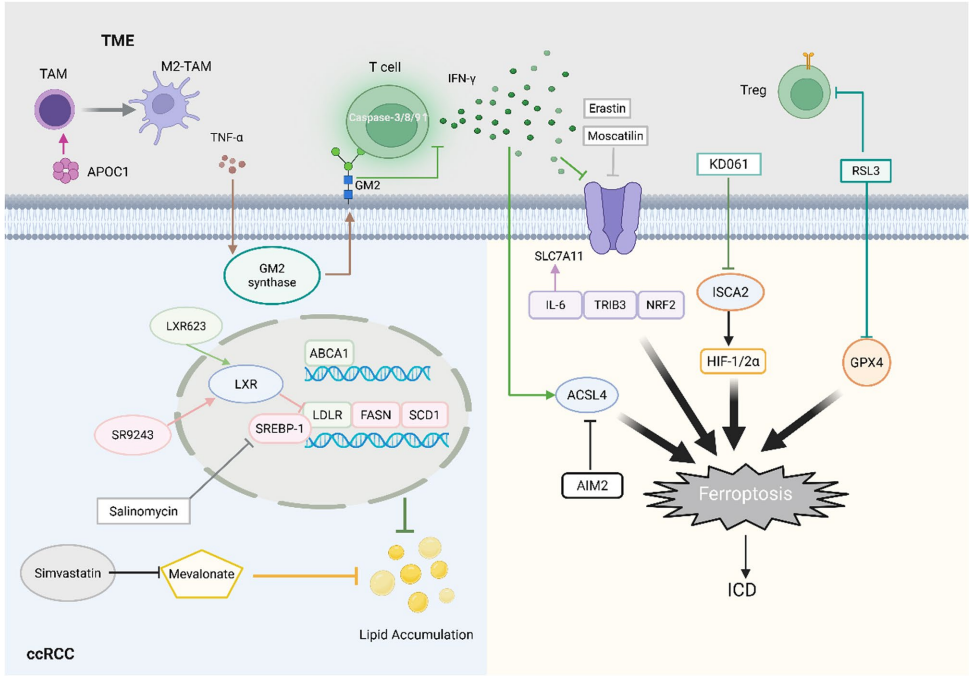
本综述系统阐述了肾透明细胞癌(ccRCC)中脂质代谢重编程与铁死亡抵抗间的精密互作网络。文章揭示了ccRCC通过上调CD36、SCARB1等脂质摄取蛋白和ACLY、FASN等合成酶系驱动脂质堆积,同时通过xCT-GSH-GPX4轴和FSP1-CoQ10H2系统构建抗氧化防御屏障。作者创新性提出靶向脂质代谢(如ACC、SCD1抑制剂)与诱导铁死亡(如GPX4抑制剂RSL3)的协同治疗策略,为克服ccRCC耐药性提供了代谢干预新范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘