
-

生物通官微
陪你抓住生命科技
跳动的脉搏
THBS1通过RhoA/ROCK1通路调控高糖环境下HTR8/SVneo细胞功能与胰岛素敏感性研究
【字体: 大 中 小 】 时间:2025年10月04日 来源:Diabetology & Metabolic Syndrome 3.9
编辑推荐:
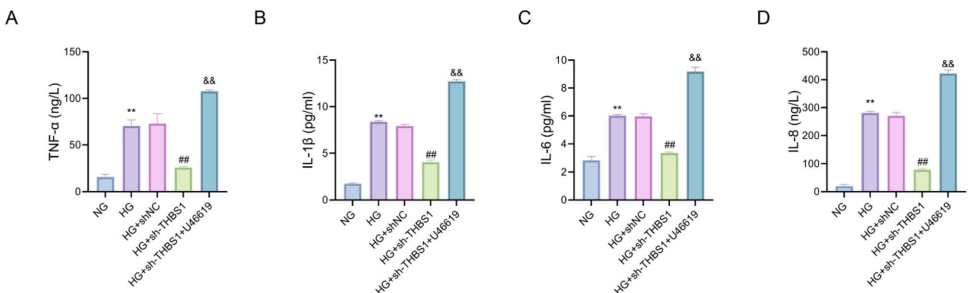
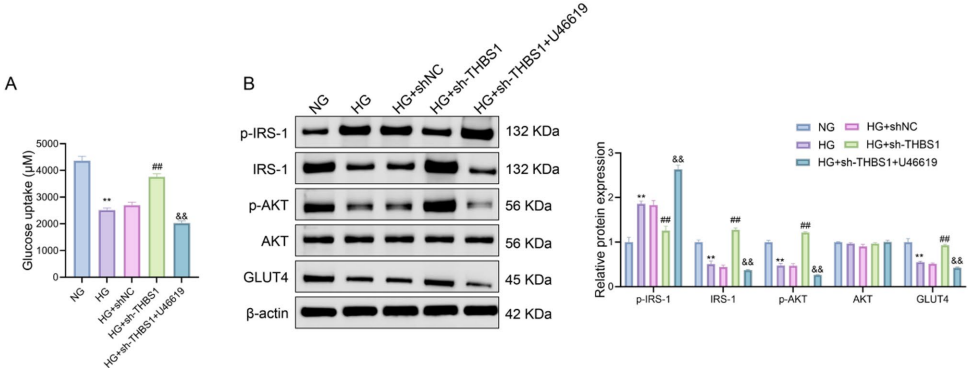
本研究聚焦妊娠期糖尿病(GDM)发病机制,探讨了血小板反应蛋白1(THBS1)在高糖环境下对胎盘滋养层细胞功能及胰岛素敏感性的调控作用。研究人员通过体外实验证实THBS1通过激活RhoA/ROCK1信号通路,抑制胰岛素信号传导(IRS-1/AKT/GLUT4),降低细胞活力与迁移能力,并促进炎症因子(TNF-α/IL-1β/IL-6/IL-8)分泌。该研究为GDM的靶向治疗提供了新的理论依据和潜在干预靶点。


 生物通微信公众号
生物通微信公众号
知名企业招聘