
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:粒细胞单核细胞吸附疗法治疗慢性炎症性疾病与脓毒症
【字体: 大 中 小 】 时间:2025年10月05日 来源:Journal of Intensive Care 4.7
编辑推荐:
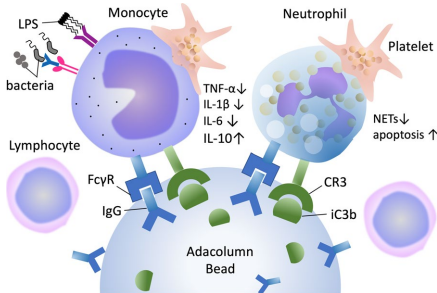
本综述系统阐述了粒细胞单核细胞吸附疗法(GMA)在慢性炎症性疾病及脓毒症中的应用进展。作为一种选择性清除活化粒细胞与单核细胞的体外免疫调节技术,GMA通过吸附柱(Adacolumn?)靶向去除促炎细胞,调节细胞因子谱(如降低TNF-α、IL-6,提升IL-10),重塑免疫稳态。其在溃疡性结肠炎(UC)、类风湿关节炎(RA)等慢性疾病中疗效显著,近年更拓展至脓毒症等急性炎症领域,日本已于2025年批准其用于脓毒症辅助治疗,为免疫过度激活相关疾病提供了非药物干预新策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘