
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:乳腺癌中乳酸化修饰的研究进展
【字体: 大 中 小 】 时间:2025年10月05日 来源:Hormones & Cancer
编辑推荐:
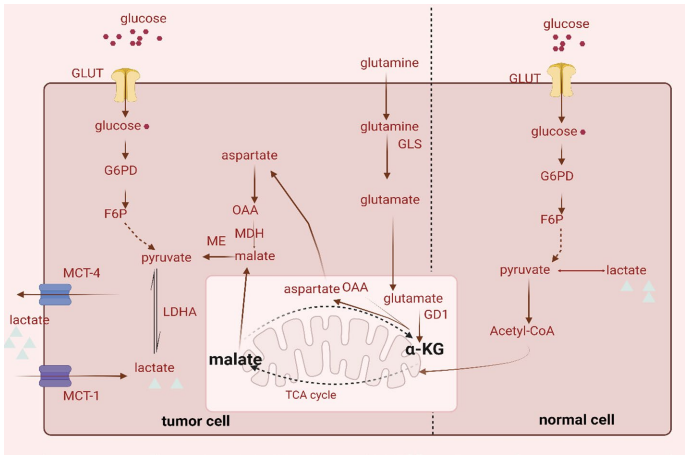
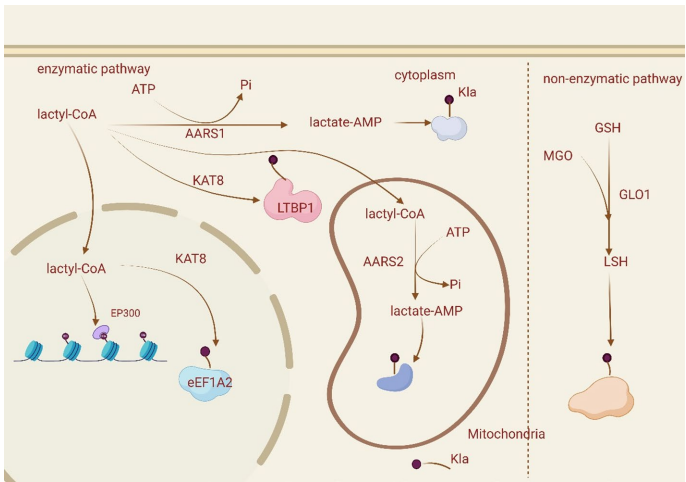
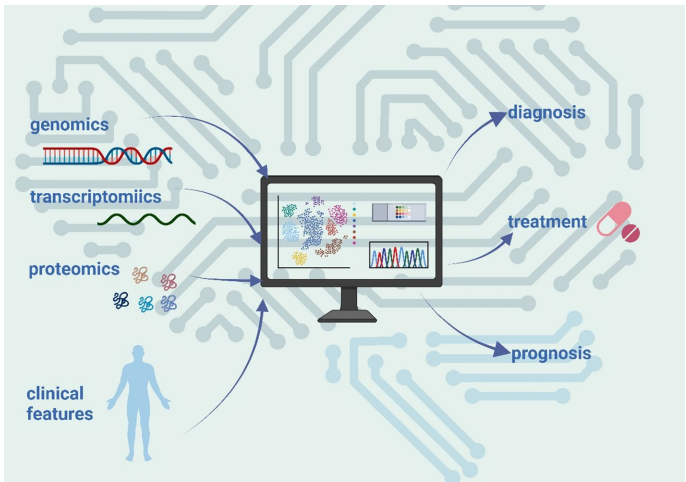
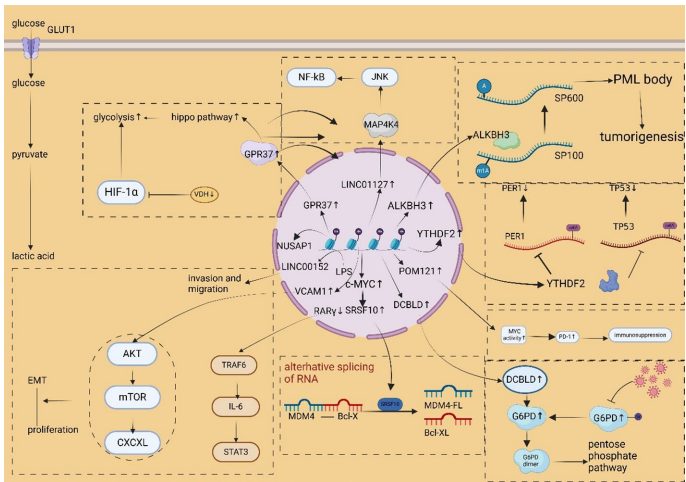
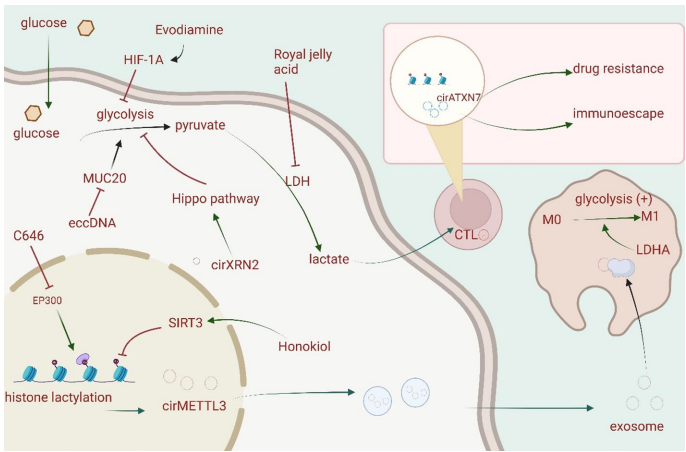
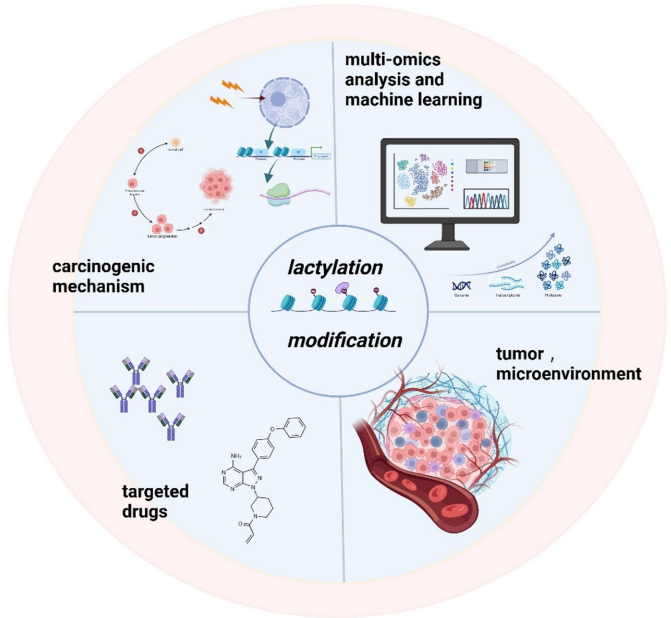
本综述系统探讨了乳酸化修饰(Lactylation)在乳腺癌中的关键作用,这一新型翻译后修饰(PTM)将代谢重编程与表观遗传调控紧密相连。文章详细阐述了乳酸化在肿瘤微环境(TME)中的调控机制,及其对乳腺癌细胞增殖、迁移、侵袭和化疗耐药性的影响。重点介绍了组蛋白(如H3K18la、H4K12la)和非组蛋白的乳酸化靶点,以及相关的信号通路(如PI3K/AKT、Hippo)。文章还强调了机器学习(Machine Learning)在乳酸化位点预测和预后模型构建中的应用,并展望了以乳酸化为靶点(如p300、HDACs)的新型治疗策略,为乳腺癌的精准诊断和治疗提供了新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘