
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于NIR-IIb荧光比率成像的肿瘤相关中性粒细胞实时监测新方法推动癌症免疫治疗精准化
《Nature Communications》:NIR-IIb fluorescence ratiometric imaging of tumor-associated neutrophils for immunotherapy efficacy monitoring and strategy optimization
【字体: 大 中 小 】 时间:2025年12月06日 来源:Nature Communications 15.7
编辑推荐:
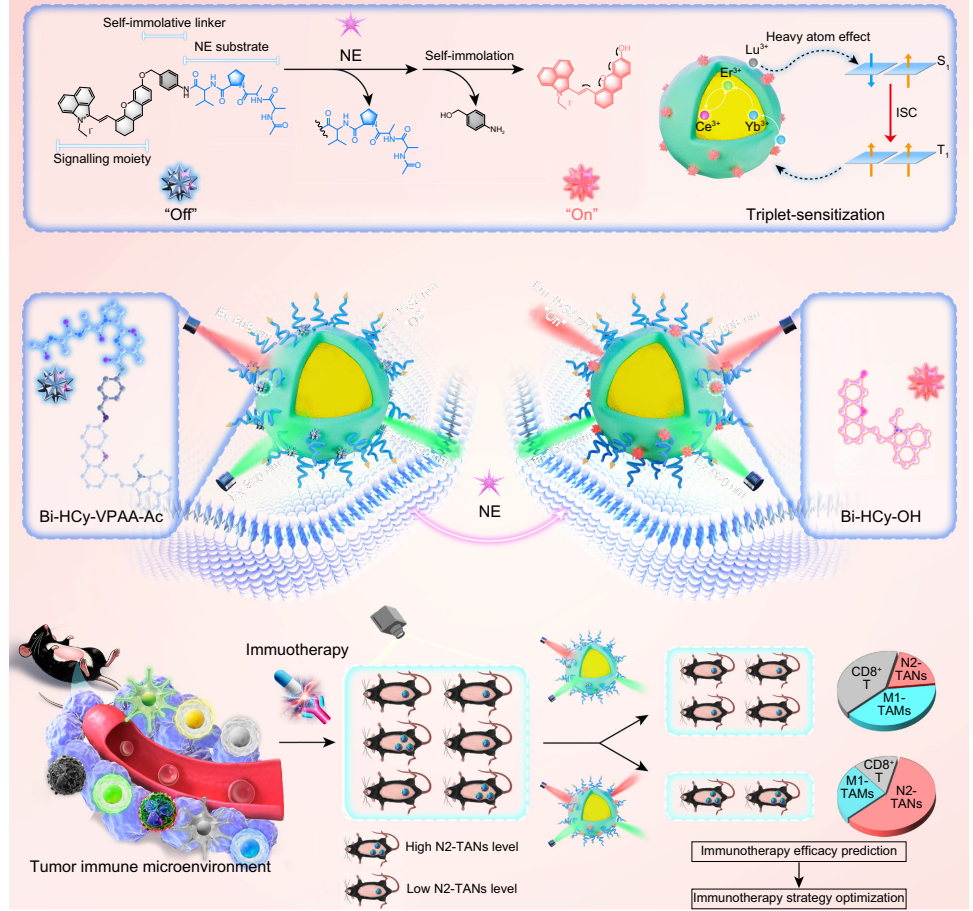
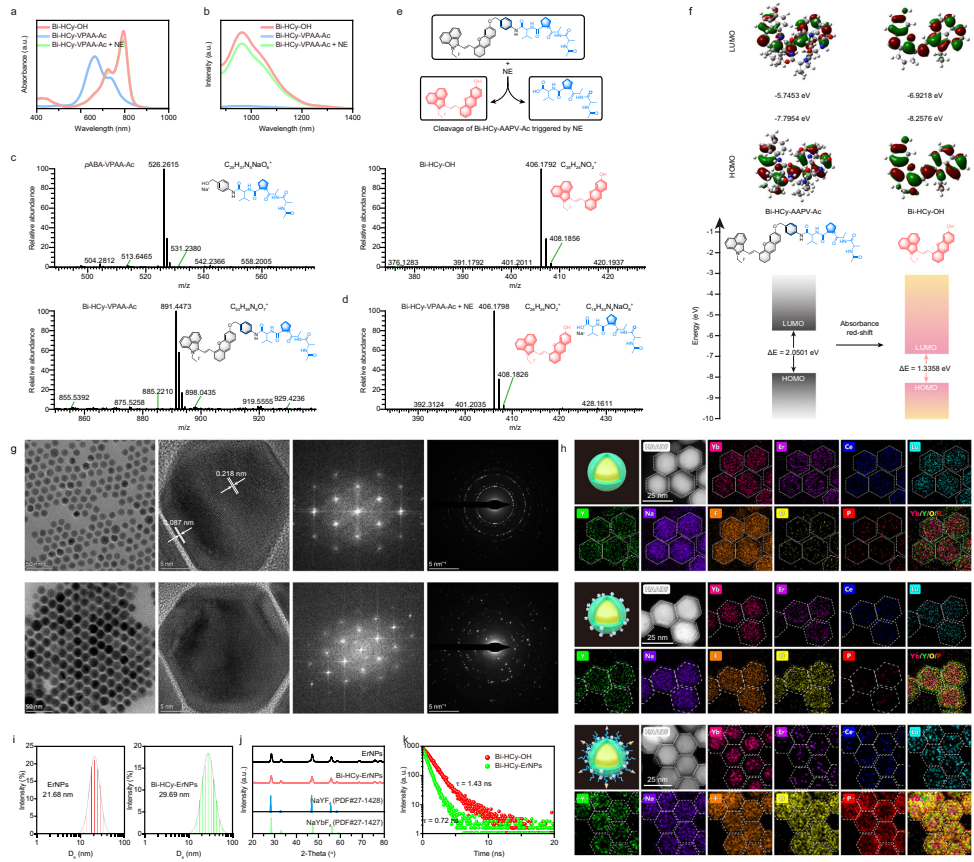
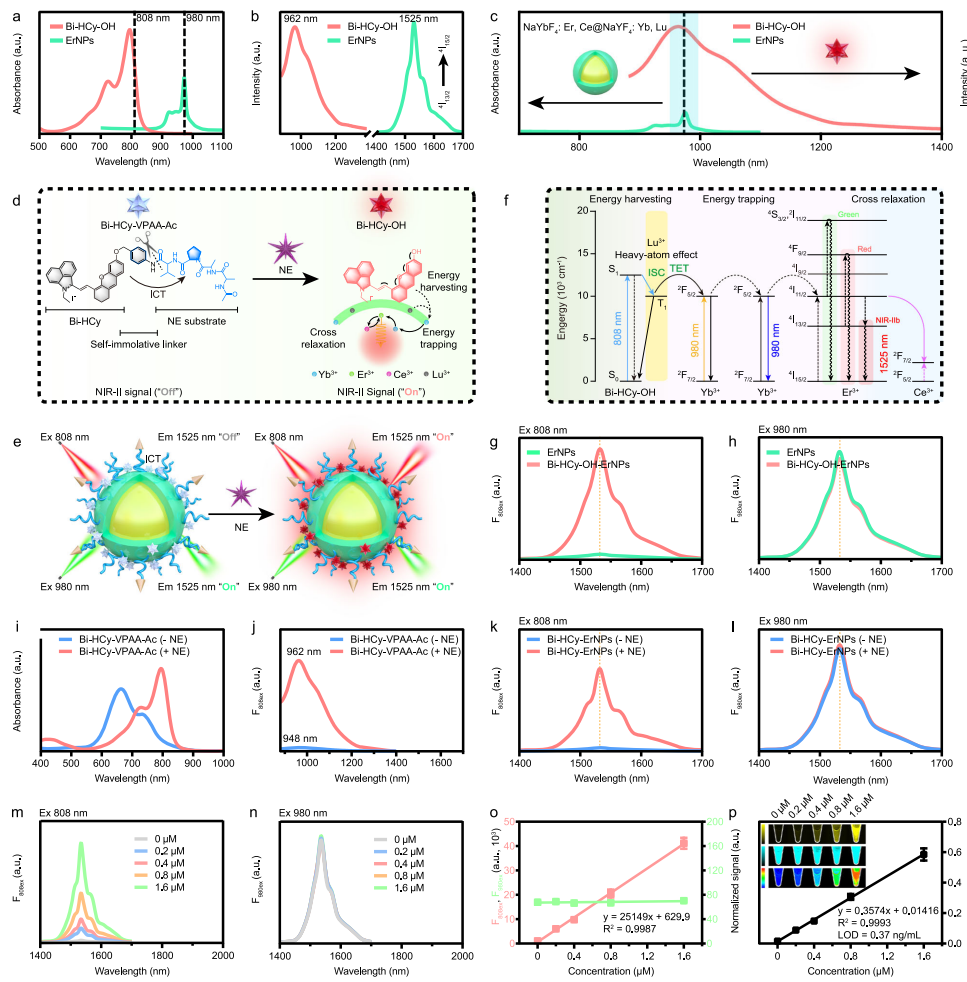
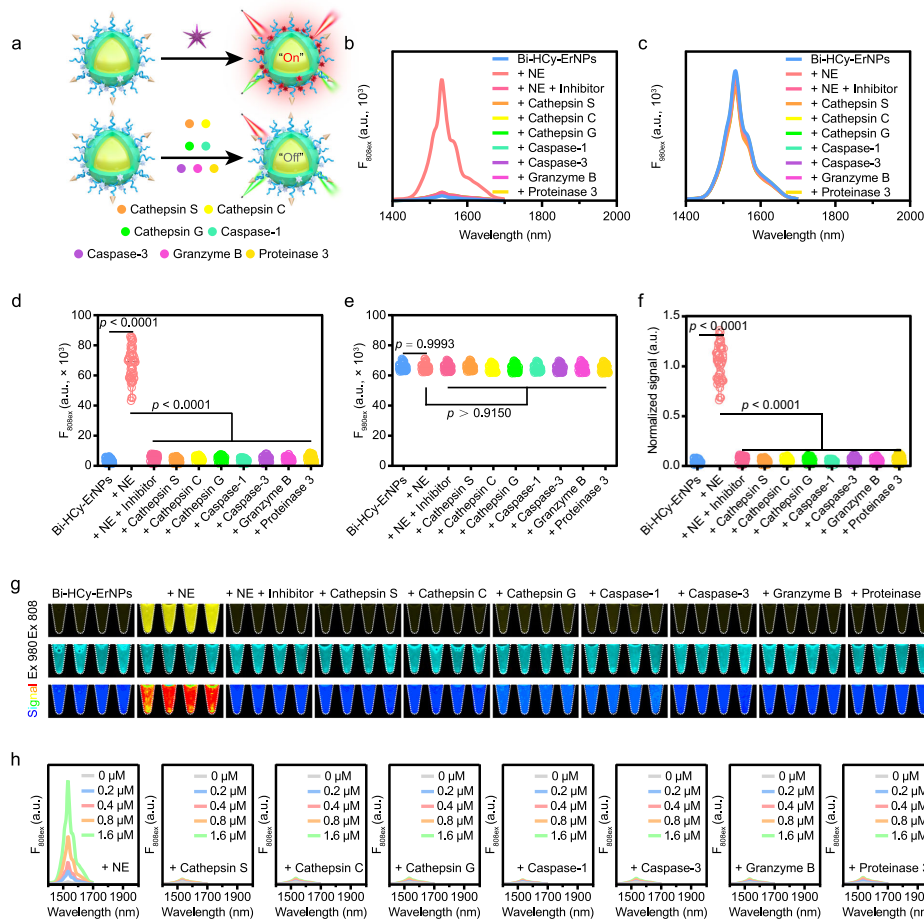
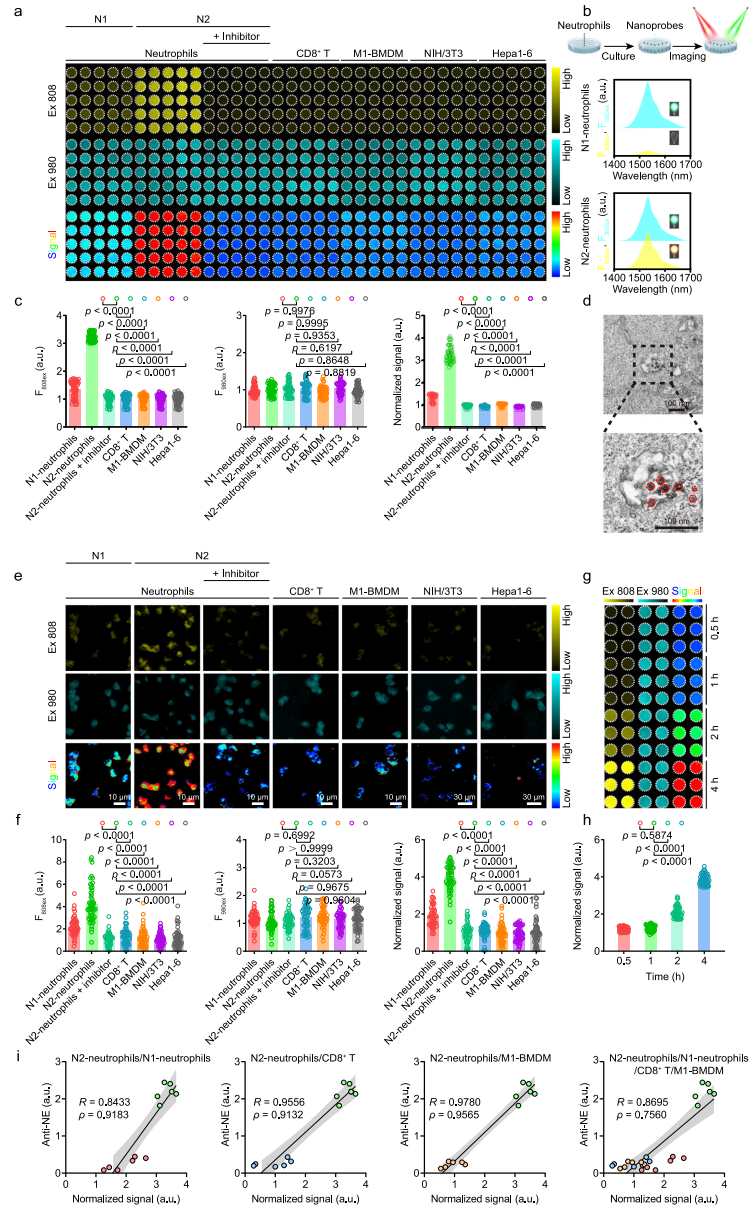
本研究针对癌症免疫治疗疗效评估缺乏早期动态监测工具的难题,开发了一种近红外二区b窗口(NIR-IIb)荧光比率成像纳米探针,通过特异性响应肿瘤相关中性粒细胞(TANs)标志性酶——中性粒细胞弹性蛋白酶(NE)的活性变化,实现了活体内TANs免疫状态的可视化定量监测。该探针利用铒基纳米颗粒(ErNPs)与NE可切割肽段偶联的苯并[cd]吲哚半花菁染料(Bi-HCy-VPAA-Ac)构建能量转移体系,在808 nm和980 nm双通道激发下产生自校准的1532 nm荧光比率信号(F1532em, 808ex/F1532em, 980ex)。在肝癌模型(Hepa1-6/H22)中成功区分免疫治疗应答/非应答个体,为个性化治疗策略调整提供了实时可视化工具。
 生物通微信公众号
生物通微信公众号
知名企业招聘