
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:间充质干细胞来源的外泌体作为铁死亡潜在治疗策略
【字体: 大 中 小 】 时间:2025年07月16日 来源:Stem Cell Research & Therapy 7.1
编辑推荐:
这篇综述系统阐述了间充质干细胞外泌体(MSC-Exos)通过调控铁死亡(ferroptosis)通路在多种疾病中的治疗潜力。文章详细分析了MSC-Exos携带的miRNAs、抗氧化酶等活性成分如何靶向GPX4/SLC7A11/ACSL4等关键分子,在神经退行性疾病、心血管疾病和癌症等领域展现出独特的组织修复与细胞保护作用,为开发无细胞治疗策略提供了新思路。
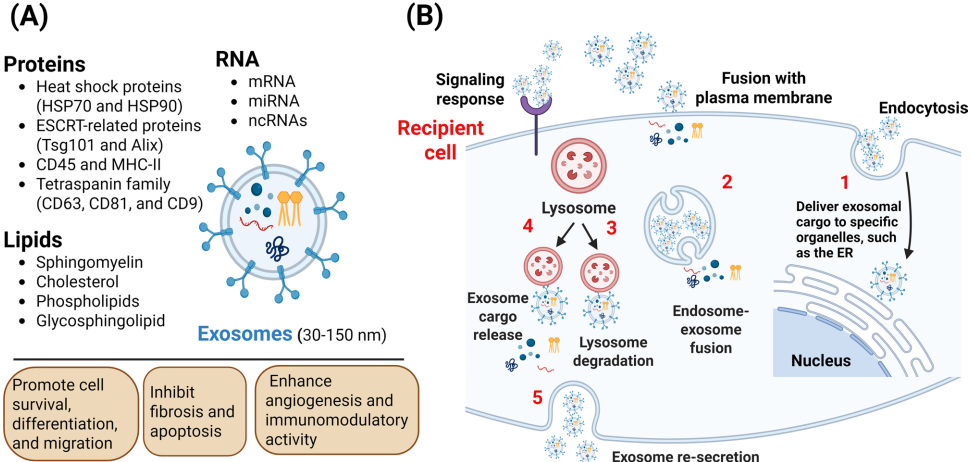
铁死亡(Ferroptosis)作为一种铁依赖性脂质过氧化驱动的程序性细胞死亡方式,与多种病理过程密切相关。近年研究发现,间充质干细胞来源的外泌体(MSC-Exos)因其天然生物相容性和多样的细胞保护效应,成为调控铁死亡的新型治疗工具。这些纳米级细胞外囊泡(30-150nm)携带蛋白质、脂质和microRNA等生物活性物质,能靶向调节铁死亡相关通路,包括活性氧(ROS)生成、谷胱甘肽(GSH)代谢和脂质过氧化等关键环节。
间充质干细胞(MSCs)具有多向分化潜能和自我更新能力,可从骨髓、脂肪组织、脐带等多种组织中分离获得。其表面标志物CD44、CD73、CD90和CD105阳性,而CD45、CD34等造血标志物阴性。不同于传统认知,MSCs主要通过旁分泌机制而非直接分化发挥治疗作用,其中外泌体(Exos)作为重要的效应分子,避免了细胞治疗潜在的致瘤性和免疫排斥风险。

外泌体通过内体-溶酶体途径在多泡体(MVBs)中形成,依赖ESCRT复合物(ESCRT-0至ESCRT-III)调控其生成和释放。这些囊泡富含41,860种蛋白质、7,540种RNA和1,116种脂质,其中CD63、CD81等四跨膜蛋白家族成员是其特征性标志物。根据来源不同,外泌体可分为天然型和工程化外泌体,前者又包括正常细胞和肿瘤细胞来源等亚类。
铁死亡的核心特征包括铁代谢紊乱、GSH耗竭和GPX4活性抑制导致的脂质过氧化物累积。关键通路涉及:
系统Xc-/GSH/GPX4轴:胱氨酸摄取受阻导致GSH合成减少
ACSL4介导的多不饱和脂肪酸(PUFAs)过氧化
Nrf2调控的抗氧化防御系统
铁过载引发的Fenton反应
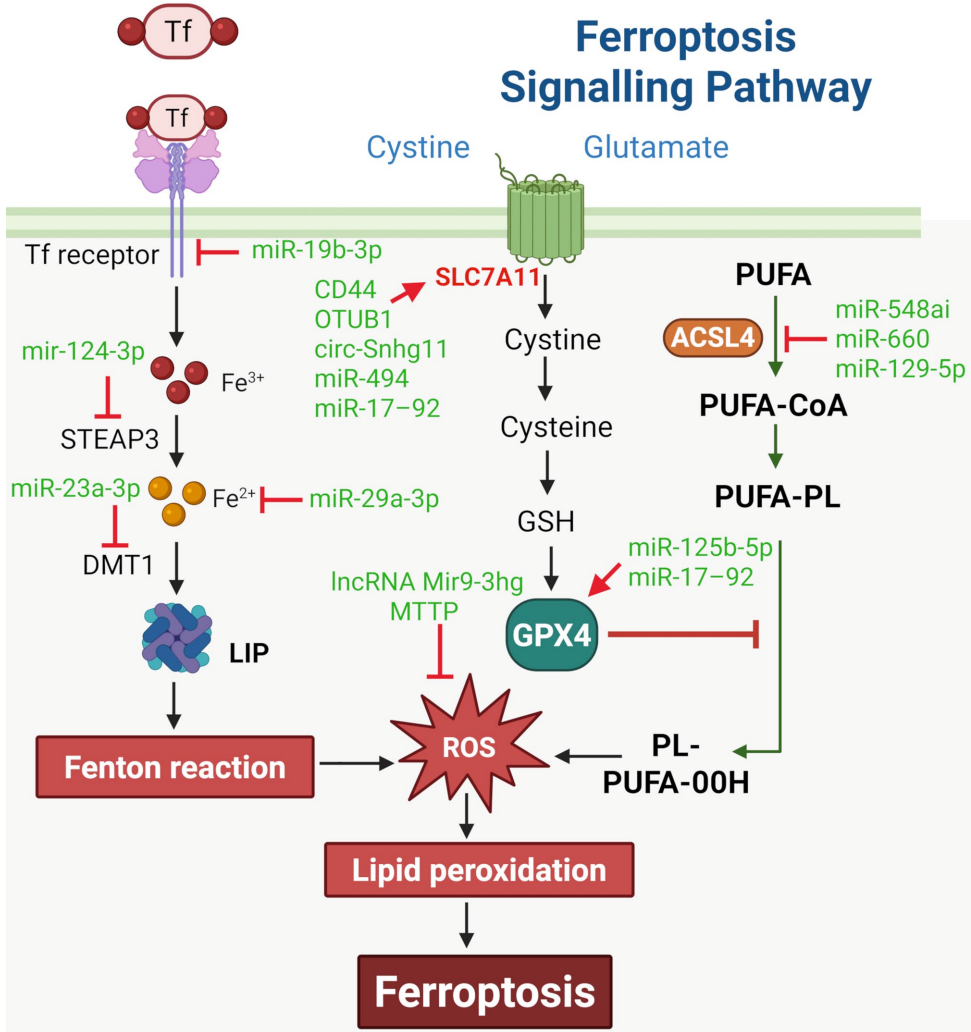
MSC-Exos通过多途径抑制铁死亡:
miRNA调控:如miR-4443靶向FSP1、miR-23a-3p抑制DMT1等
递送抗氧化酶:GPX1、Trx1等
维持铁稳态:下调STEAP3等铁调节蛋白
激活保护性通路:Nrf2/HO-1、SIRT1等
阿尔茨海默病:通过IL-6/IL-10/VEGF减少Aβ诱导的氧化损伤
帕金森病:CDC42抑制ACSL4依赖的铁死亡通路
脑卒中:circBBS2/miR-494/SLC7A11轴减轻缺血再灌注损伤
心肌缺血:circ-Snhg11上调GPX4表达
阿霉素心脏毒性:Trx1激活mTORC1促进GPX4合成
炎症性肠病:miR-129-5p靶向ACSL4
急性肝损伤:CD44/OTUB1维持SLC7A11功能
肝细胞癌:miR-122增强索拉非尼敏感性
结直肠癌:MTTP调控脂质ROS代谢
当前面临的主要障碍包括:
外泌体异质性:来源和制备方法影响组成
递送效率:需要靶向修饰提高组织特异性
规模化生产:标准化工艺尚未建立
免疫原性:长期安全性需进一步评估
未来发展方向聚焦于工程化外泌体设计,结合CRISPR等技术开发精准治疗策略,以及与铁螯合剂等药物的联合治疗方案。尽管临床研究尚处起步阶段,MSC-Exos独特的跨屏障递送能力和多靶点调控特性,使其在铁死亡相关疾病领域展现出广阔的应用前景。
 生物通微信公众号
生物通微信公众号
知名企业招聘