
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:miRNA治疗早发性卵巢功能不全的新挑战与机遇
【字体: 大 中 小 】 时间:2025年07月16日 来源:Stem Cell Research & Therapy 7.1
编辑推荐:
这篇综述系统阐述了microRNA(miRNA)在早发性卵巢功能不全(POF)治疗中的突破性进展。通过调控颗粒细胞(GCs)凋亡、激素分泌和氧化应激等关键通路(如PTEN/PI3K/AKT、p38 MAPK),外泌体miRNAs(如miR-144-5p、miR-21-5p)展现出优于传统激素替代疗法(HRT)的靶向治疗潜力。文章特别强调了基于FSHR配体的卵巢靶向递送技术对临床转化的推动作用。
早发性卵巢功能不全(POF)作为女性生殖健康的重要威胁,其治疗策略正经历从传统激素替代向精准分子疗法的范式转变。最新研究表明,微小RNA(miRNA)通过多靶点调控网络,为恢复卵巢功能提供了全新干预思路。
POF定义为40岁前卵巢功能衰退,伴随卵泡刺激素(FSH>25 IU/L)升高和抗苗勒管激素(AMH)降低。遗传因素(如FOXL2突变)占病例的20-25%,而化疗药物(如环磷酰胺CTX)可通过诱导颗粒细胞凋亡加速卵泡闭锁。病理特征显示,颗粒细胞异常死亡导致卵泡微环境失衡,继而引发雌激素(E2)分泌缺陷和血管生成障碍。
人类基因组编码2588个miRNA,通过结合mRNA 3'UTR调控60%蛋白质编码基因。在POF进程中,外泌体包裹的miRNA表现出独特优势:miR-144-5p通过抑制PTEN激活PI3K/AKT通路,使化疗损伤的颗粒细胞凋亡率降低60%;而miR-146a-5p则通过Dab2ip/Ask1/p38-MAPK轴缓解氧化应激,使超氧化物歧化酶(SOD)活性提升2倍。值得注意的是,羊水干细胞(AFSC)来源的miR-10a能协同抑制促凋亡因子Bim,将卵泡闭锁率降低50%。
卵泡刺激素受体(FSHR)介导的靶向递送成为研究热点。实验显示,FSHβ81-95肽修饰的纳米颗粒可实现卵巢特异性蓄积,而人脐带间充质干细胞(HucMSC)外泌体携带的miR-126-3p通过靶向PIK3R2,使血管内皮生长因子(VEGF)表达提升4倍。pH敏感的Eudragit°E100纳米平台更实现2.3倍生物利用度提升。
尽管MRX34(miR-34a脂质体)等疗法已在肿瘤领域进入I期试验,但POF治疗仍面临物种差异(如人类3'UTR结合位点变异)、规模化生产等技术瓶颈。最新解决方案包括:①CRISPR构建的BMP15 A180T突变模型;②诱导多能干细胞(iPSC)分化的卵巢类器官;③基于单细胞测序的跨物种调控网络分析。
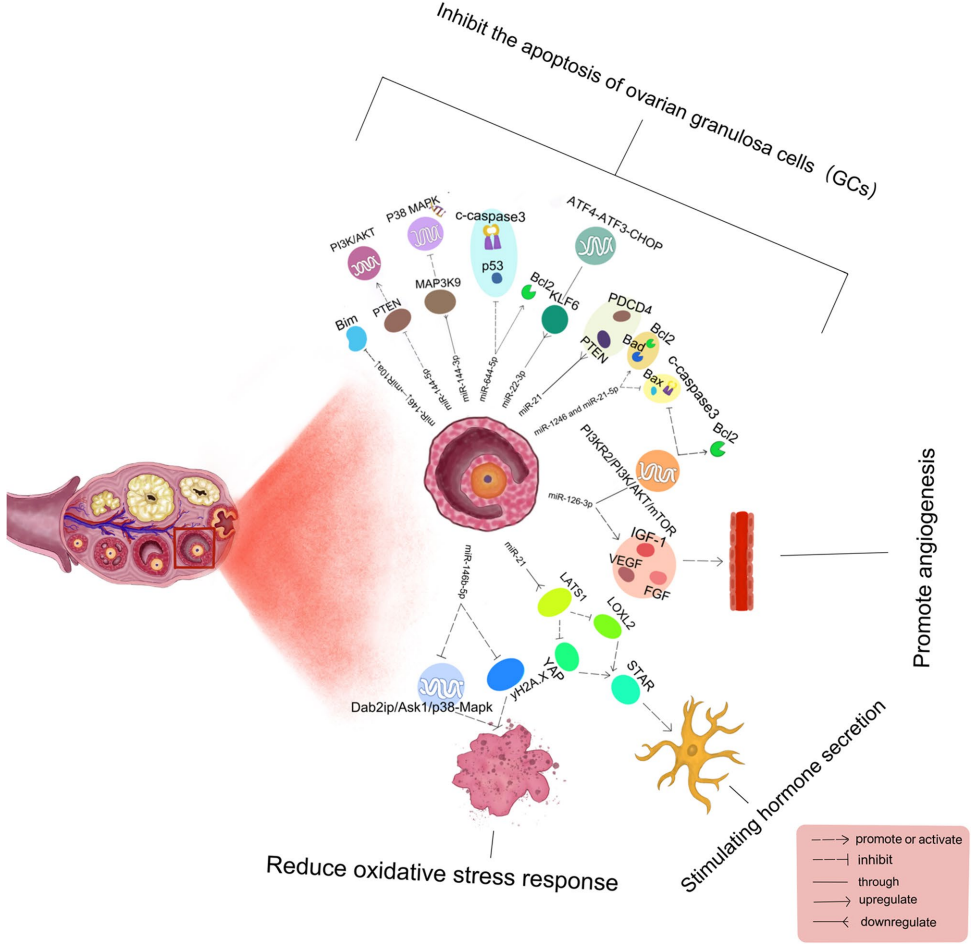
植物源miRNA(如miR2911)的跨物种调控能力为口服制剂开发提供新思路。而多靶点联合策略(如miR-21-5p与PDCD4/PTEN共沉默)可能成为逆转卵巢衰老的关键。随着Lamp2b-HUR融合蛋白等工程化外泌体技术的成熟,个体化miRNA疗法有望在未来5年内进入POF临床实践。
 生物通微信公众号
生物通微信公众号
知名企业招聘