
-

生物通官微
陪你抓住生命科技
跳动的脉搏
ALR基因修饰脂肪间充质干细胞外泌体通过促进再生和保护线粒体介导肝脏缺血再灌注损伤的肝保护作用
【字体: 大 中 小 】 时间:2025年07月16日 来源:Stem Cell Research & Therapy 7.1
编辑推荐:
本研究针对肝脏缺血再灌注损伤(IRI)联合部分肝切除后修复难题,创新性地将基因治疗与无细胞疗法结合,通过ALR基因修饰脂肪间充质干细胞(ADSCs)获得高表达ALR的外泌体(ADSC-ALR-Exo)。研究证实ADSC-ALR-Exo能显著减轻肝组织损伤、减少细胞凋亡、促进肝再生,并通过调控线粒体动力学(抑制Drp1介导的分裂、促进OPA1/Mfn2介导的融合)保护线粒体结构与功能,为肝脏手术并发症治疗提供了新策略。
肝脏作为人体重要的代谢器官,在经历缺血再灌注损伤(Ischemia-Reperfusion Injury, IRI)和部分切除手术后,常面临再生能力不足、线粒体功能障碍等临床难题。传统治疗手段难以同时解决组织修复与细胞能量代谢失衡的双重挑战,而间充质干细胞(Mesenchymal Stem Cells, MSCs)衍生的外泌体(Exosomes)因其天然的信息传递能力和低免疫原性,成为再生医学的新希望。然而,普通外泌体的治疗效果有限,如何通过基因工程增强其靶向修复能力,是当前研究的突破口。
针对这一科学问题,东北农业大学的研究团队在《Stem Cell Research & Therapy》发表重要成果。研究人员创新性地将肝再生关键因子——肝再生增强因子(Augmenter of Liver Regeneration, ALR)基因导入小型猪脂肪间充质干细胞,成功获得ALR高表达的外泌体(ADSC-ALR-Exo)。通过建立小型猪腹腔镜肝IRI联合部分肝切除模型,系统评估了该外泌体对肝脏多维度修复的作用机制。
研究主要采用四项关键技术:1)腺病毒载体介导ALR基因转染ADSCs;2)超速离心法联合超滤技术分离外泌体;3)建立小型猪腹腔镜肝IRI联合门静脉注射治疗模型;4)整合透射电镜、Western blot、qRT-PCR等多组学方法分析线粒体动态变化。
研究结果揭示:
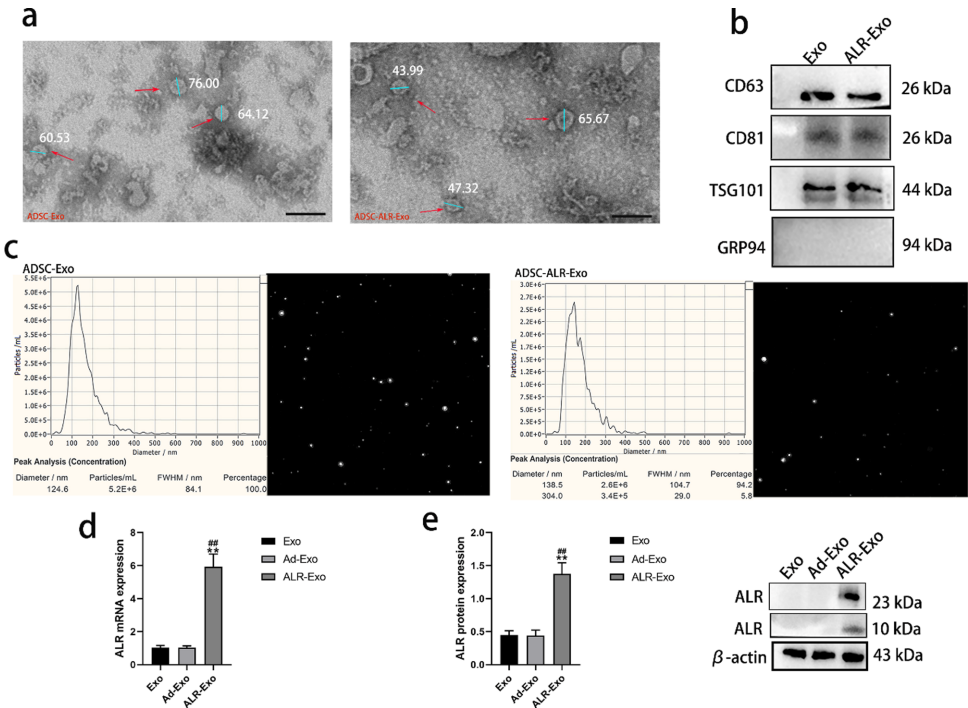
外泌体特性验证
通过透射电镜观察到ADSC-ALR-Exo保持典型杯状双膜结构(直径30-150nm),Western blot检测到CD63/CD81/TSG101阳性标记,且ALR蛋白表达量较普通外泌体显著提升(p<0.01)。
肝损伤修复效应
术后3天病理显示,IRI组出现广泛出血性坏死,而ADSC-ALR-Exo组仅见轻微空泡变性。血清学检测证实ALR-Exo较普通Exo更显著降低ALT/AST水平(p<0.01),且能加速术后7天肝功能指标复常。
凋亡抑制机制
TUNEL染色显示ALR-Exo使凋亡细胞减少50%以上(p<0.01),通过下调Bax/Bcl-2比值和caspase3/8/9活性,同时抑制死亡受体(Fas/FasL)和线粒体(Cytc/APAF1)双凋亡通路。
再生促进作用
ki67免疫荧光显示ALR-Exo组增殖细胞增加2.3倍(p<0.01),通过上调HGF/STAT3/PCNA等促再生因子,同时抑制TGF-β/SOCS3负调控信号,形成更有利的再生微环境。
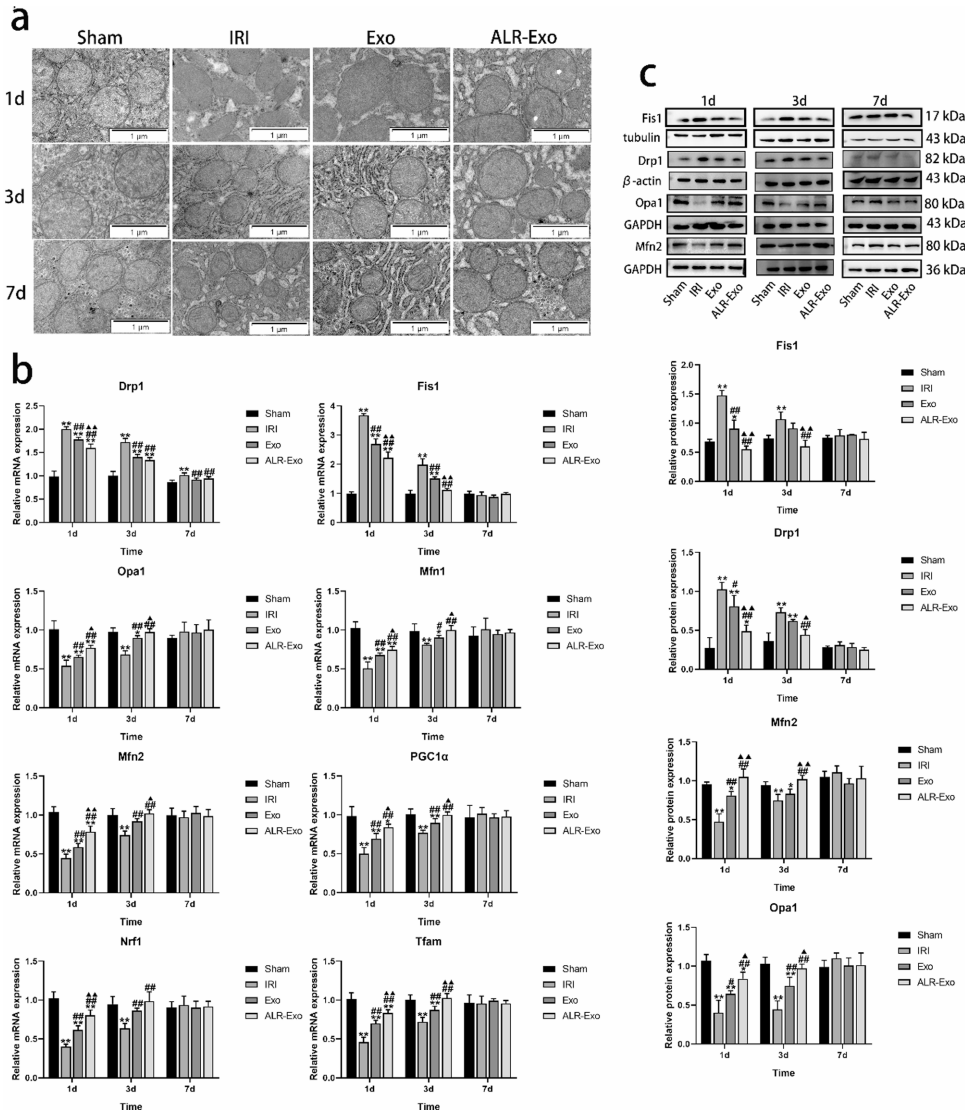
线粒体保护作用
电镜观察到ALR-Exo维持线粒体嵴结构完整,使ATP产量提升68%(p<0.01)。机制上通过抑制分裂蛋白Drp1/Fis1(下调40%),促进融合蛋白OPA1/Mfn2(上调3倍)及生物合成关键因子PGC1α/Tfam的表达,并减少LC3B与线粒体的共定位(mitophagy降低55%)。
这项研究首次证实ALR基因修饰可增强外泌体的多靶点修复能力:在组织层面通过调节再生相关因子网络促进肝细胞增殖;在细胞层面通过双重抗凋亡机制提高存活率;在亚细胞层面通过重构线粒体动力学平衡能量代谢。特别值得注意的是,ALR-Exo对线粒体的保护作用可能成为治疗其他缺血性器官损伤的通用策略。研究为开发基于工程化外泌体的精准治疗方案提供了实验依据,也为临床转化建立了大型动物模型技术平台。未来研究可进一步探索外泌体内容物的时序释放规律及其与内源性ALR信号的协同机制。
 生物通微信公众号
生物通微信公众号
知名企业招聘