
-

生物通官微
陪你抓住生命科技
跳动的脉搏
中国创新抗癌药物优先审评路径的临床价值评估:2015-2024年疗效与安全性观察研究
【字体: 大 中 小 】 时间:2025年07月16日 来源:BMC Cancer 3.4
编辑推荐:
中国国家药监局(NMPA)实施的优先审评程序(PRP)显著缩短了抗癌药物审批时间(263.5 vs 352天,p<0.001),但分析69项适应症发现,优先审评药物虽提高患者可及性,其疗效(OS/PFS/ORR)与非优先审评药物无显著差异,且3级不良事件(AEs)风险更高(RR=1.68,p=0.017),为优化审评政策提供了关键证据。
癌症治疗领域长期面临创新药物研发周期长、患者需求迫切的矛盾。全球监管机构通过加速审批程序(如FDA的突破性疗法)应对这一挑战,但中国特有的优先审评路径(PRP)自2015年实施以来,其临床价值缺乏系统评估。南京医科大学药学院的研究团队在《BMC Cancer》发表的研究,首次全面解析了PRP对药物审批效率与临床结局的影响。
研究采用观察性对比分析方法,系统收集2015-2024年间NMPA批准的49种创新抗癌药物(69项适应症)数据。通过NDA/BLA审批时间分析、疗效终点(OS/PFS/ORR)和安全性指标(≥3级AEs/SAEs)的Meta分析,结合2020年政策修订的亚组分析,揭示了PRP的实际效果。
关键技术方法包括:1)从CDE网站和Insight数据库提取审批数据;2)通过NMPA审评报告识别关键临床试验;3)采用Cox比例风险模型比较审批时间;4)对HR、ORR等指标进行随机/固定效应模型Meta分析;5)使用Clopper-Pearson精确法计算比例置信区间。
主要结果
审批效率
优先审评使审批时间缩短88.5天(263.5 vs 352天,HR=2.40),2020年政策修订后进一步压缩至197天。

疗效比较
优先审评药物未显示显著优势:
中位PFS:9.87 vs 8.95个月(p=0.875)
中位OS:10.85 vs 20.85个月(p=0.240)
ORR合并值:54% vs 53.7%(p=0.986)
安全性差异
优先审评药物风险显著增高:
≥3级AEs风险比:1.68 vs 1.12(p=0.017)
治疗相关SAEs风险比:1.82 vs 1.39(p=0.021)
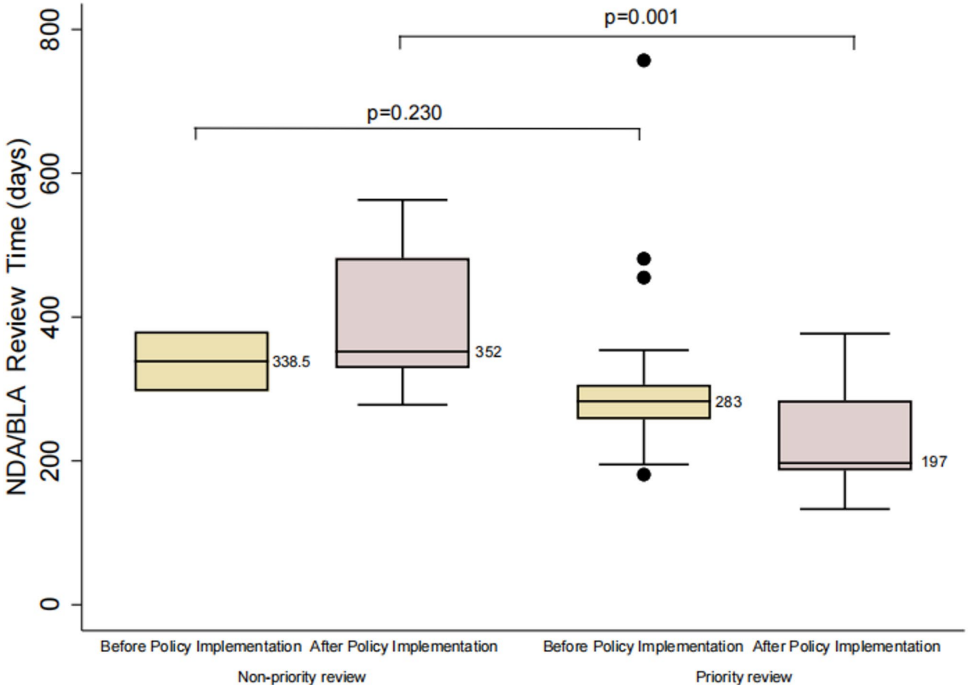
结论与意义
该研究证实PRP成功实现了加速药物可及性的政策目标,但基于ORR等替代终点的审批模式可能导致临床获益证据不足。值得注意的是,72.34%的优先审评适应症依赖单臂试验数据,这与国际经验(如Durvalumab因OS未获益退市)形成警示。研究建议:1)加强审批后疗效验证;2)优化风险收益评估框架;3)推动多区域临床试验设计以增强数据普适性。这些发现为中国深化药品审评制度改革提供了实证依据,对全球加速审批程序的优化具有参考价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘