
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脂肪-软骨轴调控IL-6/骨桥蛋白信号通路在小鼠骨关节炎中的作用机制研究
【字体: 大 中 小 】 时间:2025年07月16日 来源:Cell Death Discovery 6.1
编辑推荐:
本研究针对膝骨关节炎(OA)的发病机制,聚焦髌下脂肪垫(IPFP)通过IL-6/骨桥蛋白(OPN)信号轴调控软骨退变的关键作用。研究人员通过DMM手术建立小鼠OA模型,结合基因沉默、中和抗体干预等技术,首次揭示IPFP源性IL-6通过诱导纤维化和OPN分泌促进软骨降解的分子机制,为早期OA的靶向治疗提供了新策略。相关成果发表于《Cell Death Discovery》。
骨关节炎(OA)作为一种常见的退行性关节疾病,给全球公共卫生系统带来沉重负担。尽管现有治疗手段能缓解症状,但缺乏真正能阻止疾病进展的疗法。近年来,科学家们逐渐将目光从单纯的软骨修复转向关节微环境整体调控,其中髌下脂肪垫(IPFP)这个特殊的关节内脂肪组织引起了广泛关注。这个位于髌骨后方、与滑膜相邻的结构,因其丰富的血管网络和活跃的分泌功能,被认为是关节内重要的"生物活性因子库"。
汕头大学医学院的研究团队在《Cell Death Discovery》发表的重要研究,揭示了IPFP通过IL-6/OPN信号轴调控OA进展的全新机制。研究人员采用内侧半月板失稳(DMM)手术建立小鼠OA模型,通过组织学分析、基因表达检测、免疫荧光等技术,系统研究了IPFP在OA早期病理过程中的动态变化。研究发现,IPFP在OA早期即表现出明显的纤维化改变和炎症因子分泌特征,这种变化甚至早于软骨的明显退变。
关键技术方法包括:建立DMM诱导的小鼠OA模型;采用siRNA Cd61和IL-6中和抗体进行局部干预;通过组织共培养研究IPFP与软骨细胞的相互作用;运用组织学评分、qRT-PCR、ELISA和免疫荧光等技术进行多维度分析。
RESULTS部分的研究发现:
Histological and molecular alterations in articular cartilage of early-stage OA mice
通过OARSI评分系统证实,DMM手术后14天小鼠即出现软骨表层纤维化和垂直裂隙等早期OA特征。虽然软骨厚度无显著变化,但肥大标志物Col1a1和Col1a2表达显著上调,提示软骨稳态失衡。
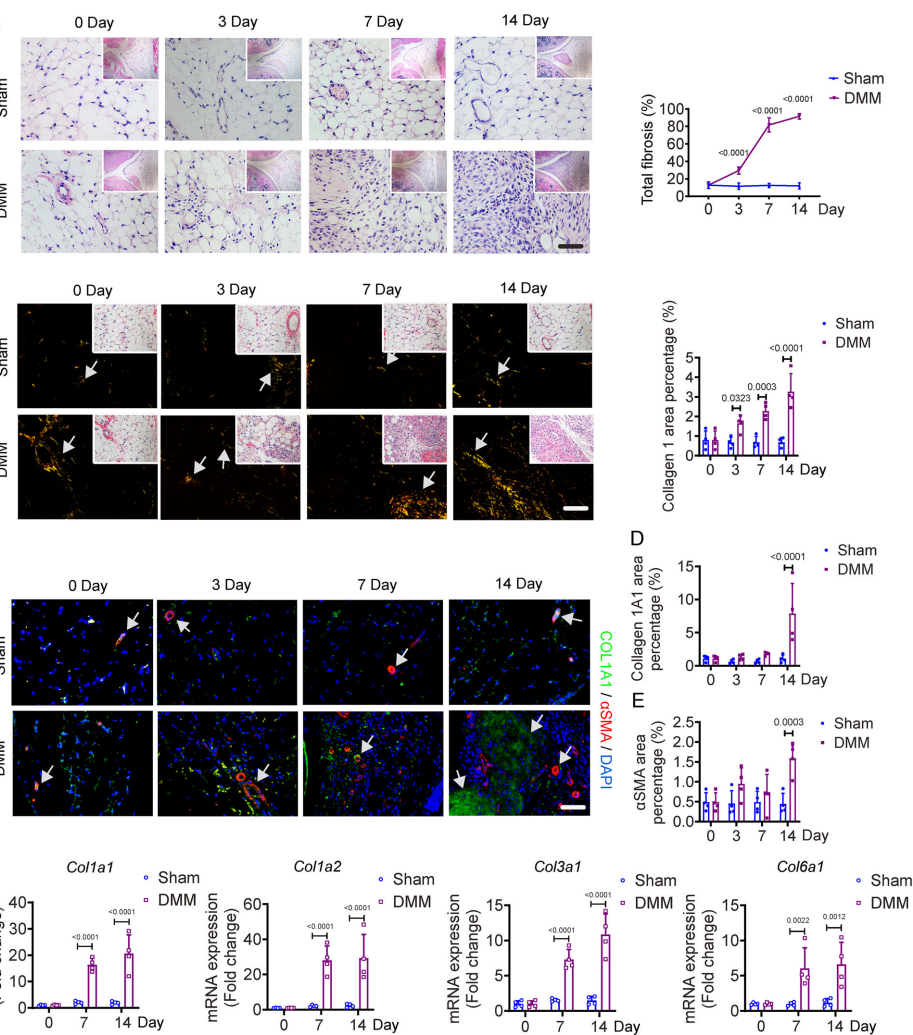
Fibrotic alteration in the IPFP of early-stage OA mice

DMM术后3天即观察到IPFP纤维化改变,14天时胶原I沉积显著增加。免疫荧光显示αSMA阳性肌成纤维细胞和血管样结构明显增多,伴随Col1a1、Col3a1等纤维化标志物表达上调。
The inflammatory responses of IPFP at early-stage OA mice
IL-6在DMM组IPFP中表达显著升高,同时伴随巨噬细胞浸润。手术切除IPFP可显著改善关节功能参数(如最大接触面积和摆动期),并减轻软骨破坏。
IPFP-derived IL-6 triggers OA progression

局部注射重组IL-6可诱导正常小鼠IPFP纤维化,而IL-6中和抗体(Nue Ab)处理则能显著抑制DMM小鼠IPFP的纤维化进程,降低Col1a1、Spp1等基因表达。
IPFP-derived IL-6 induces the OPN expression involved in the progression of articular cartilage destruction

IL-6处理可上调软骨细胞中Mmp13、Adamts5等分解代谢基因表达,而siRNA沉默Spp1(OPN编码基因)或Cd61(整合素β3)可逆转这些效应,证实IL-6通过调控OPN分泌促进软骨退变。
这项研究的重要发现在于阐明了"脂肪-软骨"对话的新机制:OA早期,IPFP通过IL-6信号通路触发纤维化重塑,同时上调OPN分泌,进而通过整合素β3等受体促进软骨细胞异常分化和基质降解。研究不仅为理解OA发病机制提供了新视角,更重要的是提出了靶向IPFP源性IL-6/OPN轴的干预策略。相比直接靶向IL-6可能带来的副作用,针对其下游效应分子OPN的干预可能更具治疗前景。该研究为开发早期OA的精准治疗提供了重要理论依据,也为其他代谢性关节疾病的治疗研究开辟了新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘