
-

生物通官微
陪你抓住生命科技
跳动的脉搏
APC启动子1B区新型插入/缺失变异导致胃结肠息肉共患病机制的发现及其临床意义
【字体: 大 中 小 】 时间:2025年09月16日 来源:Familial Cancer 2
编辑推荐:
本研究针对APC基因启动子1B区新发现的插入/缺失变异(c.-192_191delATinsTAGCAAGGG),首次揭示其同时引发胃腺癌近端息肉病(GAPPS)和家族性腺瘤性息肉病(FAP)的共患病机制。通过四代家系追踪证实该变异导致11岁儿童即需预防性胃切除,60%携带者需结肠切除术,颠覆了GAPPS与FAP互斥的传统认知,为APC相关息肉病的精准防控提供了新依据。
在遗传性肿瘤研究领域,APC基因突变长期被划分为泾渭分明的两种疾病:导致结肠数百至数千腺瘤的家族性腺瘤性息肉病(FAP),以及引发胃底腺息肉病的胃腺癌近端息肉病(GAPPS)。然而临床实践中,部分患者的表现始终挑战着这种二元分类体系。更令人困惑的是,现有指南建议GAPPS患者15岁开始胃镜筛查却忽视结肠监测,这种管理策略是否潜藏风险?
由Frankie Fann等学者发表在《Familial Cancer》的研究,通过一个四代大家系的追踪,揭开了这个谜团。该家族携带APC启动子1B区新型插入/缺失变异(c.-192_191delATinsTAGCAAGGG),表现出惊人的临床特征:11岁儿童胃部即布满上千息肉需预防性切除,39岁患者发生胃癌,60%携带者因结肠息肉需肠段切除。这种胃结肠同步受累的现象,直接挑战了现有诊疗规范。
研究采用多中心协作模式,整合家系调查、内镜影像分析和基因检测技术。关键实验方法包括:(1)对先证者进行多基因panel测序;(2)四代家系表型追溯;(3)内镜与病理结果评估;(4)变异致病性生物信息学分析。样本来源于Mayo Clinic等机构就诊的1个核心家系及其扩展亲属。
家系特征
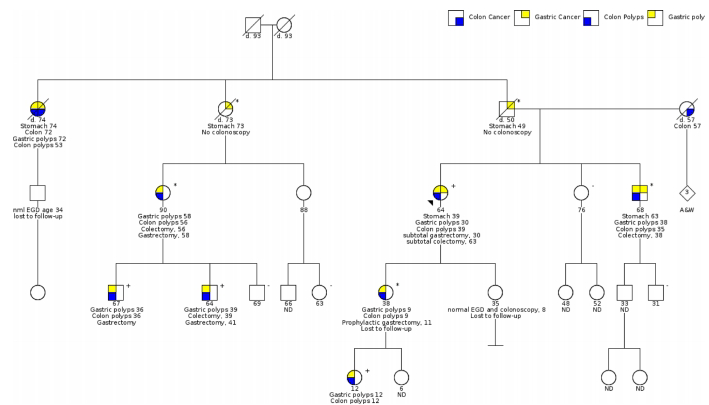
数据显示:胃息肉最早9岁发病(IV-8),12岁患者(V-4)胃部已覆盖上千20-30mm息肉;结肠息肉负荷最高达100枚(IV-3),60%携带者需结肠切除。值得注意的是,II-1患者71岁发现胃息肉,74岁即进展为胃癌,凸显快速恶变风险。
内镜发现
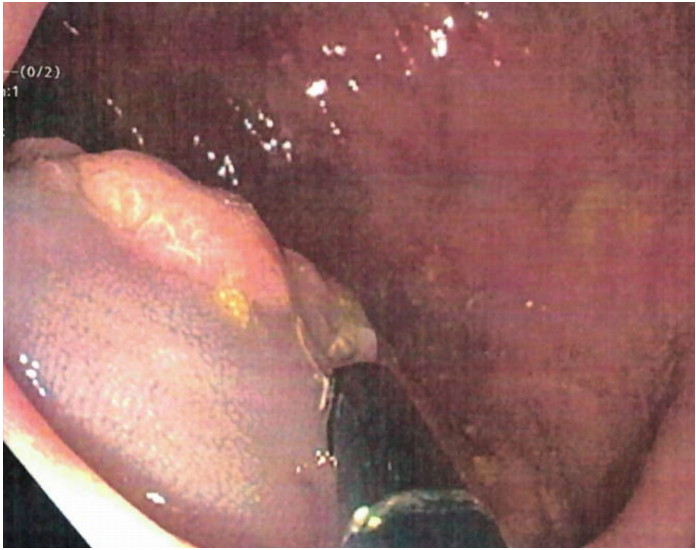

胃镜显示儿童患者胃体完全被息肉覆盖(图3A-B),组织学证实为伴高级别异型的胃底腺息肉。结肠镜捕获到巨大管状绒毛状腺瘤(图2),这种同时存在两类息肉的特征,在既往GAPPS病例中未见报道。
分子机制
变异位于APC启动子1B区YY1转录因子结合基序(-192A/-191T/-190G/-189G),该indel改变其中三个关键位点,较已知错义突变更具破坏性。研究者提出"剂量效应"假说:完全破坏启动子活性的变异(如本家系indel或大片段缺失)会导致结肠受累,而部分保留活性的错义突变仅引发GAPPS。
这项研究具有三重里程碑意义:首先,确立APC启动子1B区indel为新型致病变异类型;其次,证明GAPPS与FAP可共存,需修订现有筛查指南;最重要的是,提出基于变异类型的分层管理策略——所有APC启动子1B区变异携带者均应早期启动结肠监测。这些发现将改写遗传性息肉病的诊疗范式,为类似家系提供精准防控蓝图。
 生物通微信公众号
生物通微信公众号
知名企业招聘