
-

生物通官微
陪你抓住生命科技
跳动的脉搏
NOTCH3通过调控脂肪酸氧化和铁死亡抵抗促进侵袭性脑膜瘤恶性进展的机制研究
【字体: 大 中 小 】 时间:2025年09月16日 来源:Journal of Neuro-Oncology 3.1
编辑推荐:
本研究针对NOTCH3在侵袭性脑膜瘤中的促癌机制展开探索,揭示了NOTCH3通过上调CD36介导的脂肪酸氧化(FAO)通路,消耗细胞内脂质储备并赋予铁死亡(ferroptosis)抵抗能力的关键作用。研究人员通过单细胞测序、代谢组学和功能实验证实,NOTCH3过表达导致CPT1A/CPT2等FAO基因上调,增强线粒体氧化呼吸能力,并通过抑制脂质过氧化保护肿瘤细胞。该发现为NOTCH3阳性脑膜瘤的代谢靶向治疗提供了新思路。
脑膜瘤作为中枢神经系统常见肿瘤,其高级别亚型具有侵袭性强、易复发的临床特征。既往研究发现NOTCH3表达与脑膜瘤不良预后相关,但对其促癌机制的认识仍存在空白。尤其值得注意的是,肿瘤代谢重编程在治疗抵抗中的作用日益受到关注,而NOTCH3如何调控脑膜瘤代谢网络尚属未知。这促使Nishanth S. Sadagopan等研究者深入探索NOTCH3介导的代谢重塑机制,相关成果发表于《Journal of Neuro-Oncology》。
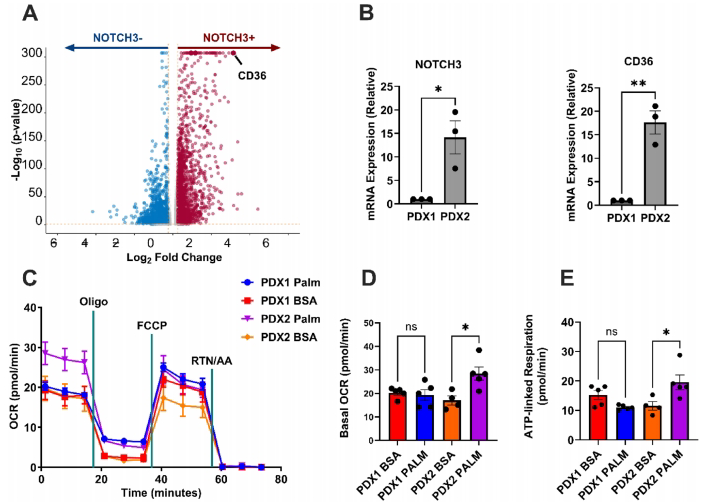
研究团队采用多组学联用策略,首先通过分析22例患者14,080个细胞的单细胞转录组数据,发现NOTCH3+肿瘤细胞显著富集脂肪酸转运蛋白CD36。为验证这一发现,研究人员建立NOTCH3细胞内结构域(ICD)过表达的CH157-MNNOTCH3 ICD细胞模型,结合患者来源的PDX模型(包括WHO 2级样本PDX1/PDX2),运用代谢组学、脂质组学和海马能量代谢分析等技术展开系统研究。
NOTCH3+人脑膜瘤细胞上调CD36表达
单细胞测序显示NOTCH3与CD36表达呈正相关,PDX2(NOTCH3high)较PDX1(NOTCH3low)表现出更高的CD36 mRNA水平。功能实验证实,PDX2在棕榈酸刺激下基础耗氧率(OCR)提升67.6%,ATP关联呼吸增强,提示脂肪酸氧化活性增强。
NOTCH3过表达改变脂质组特征
CH157-MNNOTCH3 ICD细胞中酰基肉碱(如丙酰肉碱、己酰肉碱)显著减少,靶向脂质分析显示饱和/不饱和脂肪酸池均被消耗。RNA测序发现FAO关键基因CPT1A、CPT2和HADHA上调,而脂肪酸合成酶FASN下调,证实代谢流向β氧化途径倾斜。
NOTCH3增强线粒体氧化能力
棕榈酸处理使CH157-MNNOTCH3 ICD最大呼吸容量提升223%,而对照细胞无显著变化。这种代谢表型赋予细胞显著的生存优势——在铁死亡诱导剂RSL3处理下,NOTCH3过表达细胞存活率是对照组的2.3倍,且CPT1抑制剂etomoxir可逆转该抵抗性。
研究首次阐明NOTCH3通过CD36-FAO轴重构脑膜瘤脂代谢网络:一方面通过加速脂肪酸分解维持能量供应,另一方面通过减少脂质储备降低铁死亡敏感性。这一发现不仅解释了NOTCH3阳性肿瘤的侵袭性生物学行为,更提示CPT1抑制剂与铁死亡诱导剂的联用策略可能成为潜在治疗方向。值得注意的是,NOTCH3驱动的代谢重编程不同于典型的Warburg效应,其依赖脂肪酸而非糖酵解的特性,为针对肿瘤微环境营养竞争的靶向干预提供了新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘