
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于辐射相关基因的新型蓝图:乳腺癌患者预后分层与个性化治疗策略
【字体: 大 中 小 】 时间:2025年09月24日 来源:Discover Oncology 2.9
编辑推荐:
本研究针对乳腺癌高复发率及缺乏可靠预后标志物的问题,通过多组学分析和机器学习方法构建了一个基于8个辐射相关基因(PAPSS2、APOD、DCD、PDCD4、CEACAM6、CA2、SLC16A6、NPNT)的风险预测模型。该模型能有效预测患者总体生存期、免疫微环境特征及免疫治疗反应,低风险组对吉西他滨、拉帕替尼等药物更敏感。研究为乳腺癌个性化放疗和免疫治疗提供了新策略,并开发了临床适用的R包和Excel计算工具。
乳腺癌作为全球女性发病率最高的恶性肿瘤,尽管拥有手术、化疗、放疗、靶向治疗等多种治疗手段,仍因肿瘤异质性导致部分患者预后不佳。放疗虽能显著降低复发风险并延长生存期,但患者对放疗的反应存在明显差异,这种差异直接影响临床效果和生活质量。目前缺乏可靠的生物标志物来预测放疗反应,辐射相关基因在乳腺癌中的作用机制也不明确,这成为实现精准放疗的主要障碍。
为了解决这些问题,来自温州中心医院放疗科的Hao Zhang、HongHua Lin等研究人员开展了一项多组学研究。他们通过整合TCGA、METABRIC、GEO和ICGC等多中心数据集,结合机器学习算法和单细胞转录组分析,构建了一个基于辐射相关基因的预后预测模型,该研究成果发表在《Discover Oncology》期刊上。
研究采用的主要技术方法包括:从TCGA数据库获取1050例乳腺癌患者的RNA测序数据,使用limma包识别辐射相关差异表达基因;通过Metascape进行GO和KEGG富集分析;运用随机森林(RF)、LASSO回归和stepAIC三种机器学习方法筛选特征基因;利用Seurat包分析GSE176078单细胞数据集;采用CIBERSORT算法评估免疫细胞浸润;使用maftools分析肿瘤突变负荷(TMB)和拷贝数变异(CNV)。
研究人员首先从TCGA数据库中发现133个在放疗组与非放疗组间差异表达的辐射相关基因。这些基因主要富集在体液免疫反应、胶原三聚体、细胞因子刺激反应等通路,表明辐射反应与免疫调节和细胞外基质重塑密切相关。

通过LASSO回归和随机森林算法,从133个差异基因中筛选出26个核心基因。构建的诊断列线图在TCGA队列中表现出良好的预测性能(AUC=0.712),决策曲线分析显示其具有较高的临床净效益。

分析85,692个单细胞数据发现,辐射相关基因活性主要在恶性细胞和成纤维细胞中富集,这解释了为什么放疗反应与肿瘤细胞特性密切相关。
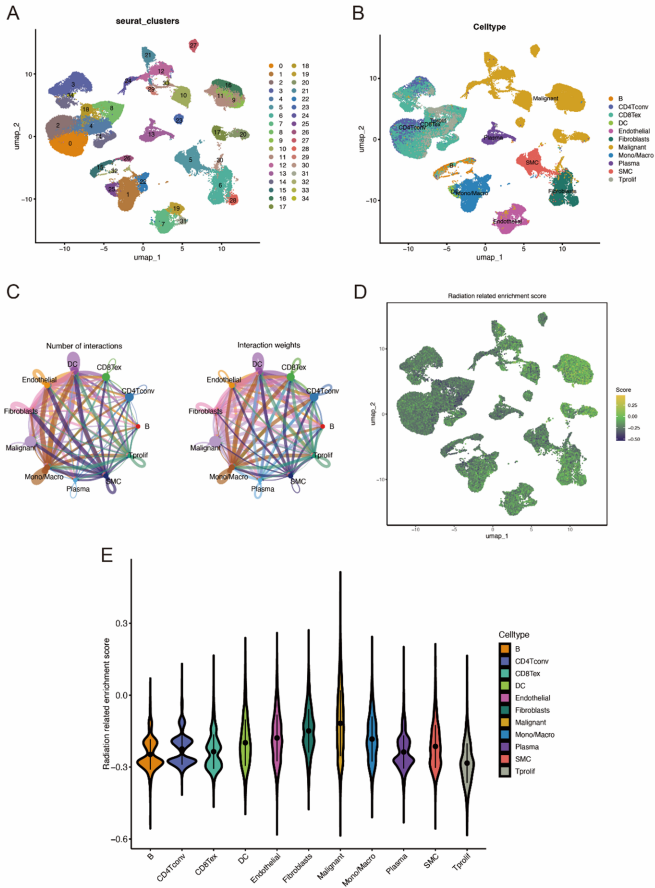
最终构建包含8个基因(PAPSS2、APOD、DCD、PDCD4、CEACAM6、CA2、SLC16A6、NPNT)的风险评分模型:风险评分=0.1083×PDCD4 + 0.0540×CEACAM6 - 0.0943×CA2 - 0.1217×SLC16A6 + 0.1163×PAPSS2 - 0.0757×APOD + 0.0873×DCD - 0.1852×NPNT。该模型在TCGA、METABRIC和ICGC多族群队列(欧洲、韩国、美国)中均验证有效,低风险组患者总生存期显著延长。

低风险组具有更有利的免疫微环境,包括更多的CD8+ T细胞、γδ T细胞和活化NK细胞,而高风险组则富含M2巨噬细胞和静止肥大细胞。低风险组对免疫检查点抑制剂(如PDCD1、BTLA等)反应更好,对吉西他滨、拉帕替尼、甲氨蝶呤和多柔比星等化疗药物更敏感。

高风险组具有更高的肿瘤突变负荷(TMB)和基因组改变比例(FGA)。TP53突变在高风险组更常见(44% vs 24%),而PIK3CA突变在低风险组更频繁(38% vs 27%)。拷贝数变异模式在风险组间也存在显著差异。
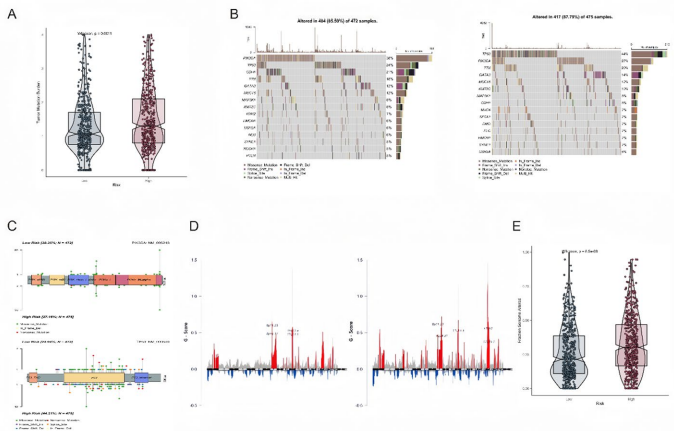
高风险组和低风险组之间的差异表达基因主要富集在免疫反应、细胞外基质、激素水平调节、程序性细胞死亡正调控和炎症反应等通路。基因集富集分析(GSEA)显示低风险组显著富集免疫和药物代谢相关通路。

研究结论与讨论部分指出,这项研究首次构建了一个基于8个辐射相关基因的乳腺癌预后预测模型,该模型能够有效区分高风险和低风险患者,预测免疫治疗反应和化疗药物敏感性。低风险患者具有更有利的免疫微环境,对免疫检查点抑制剂和常规化疗药物更加敏感,而高风险患者则表现出免疫抑制特征和更高的缺氧评分。
该研究的重要意义在于为解决乳腺癌放疗反应异质性提供了新的分子分型工具,为实现个体化精准放疗和免疫治疗提供了理论依据。研究人员开发的R包("BRCARadiationSignature")和Excel计算工具使该模型能够方便地应用于临床实践,帮助医生制定个性化的治疗策略。
然而,研究也存在一些局限性,主要是基于回顾性数据,需要前瞻性多中心研究进一步验证。此外,辐射相关基因影响放疗反应的具体分子机制仍需实验研究进一步阐明。未来研究应关注如何将该模型与现有的乳腺癌分子分型系统整合,以及如何根据风险分层制定差异化的放疗和免疫治疗策略。
这项研究为乳腺癌精准医疗提供了新的思路和工具,特别是在放疗个性化方面迈出了重要一步,有望改善乳腺癌患者的治疗效果和生活质量。
 生物通微信公众号
生物通微信公众号
知名企业招聘