
-

生物通官微
陪你抓住生命科技
跳动的脉搏
代谢相关脂肪性肝病(MASLD)患者心血管风险的代谢分层:不同代谢风险负担的影响及其临床意义
【字体: 大 中 小 】 时间:2025年09月24日 来源:European Journal of Medical Research 3.4
编辑推荐:
本刊推荐:为解决代谢相关脂肪性肝病(MASLD)患者心血管风险分层不明确的问题,研究人员开展了一项横断面研究,根据代谢风险因素数量将357例MASLD患者分为三个亚型。结果显示,代谢负担最重的亚型3(合并糖尿病、肥胖及≥2项代谢异常)心血管风险显著升高(平均ASCVD评分0.112±0.108),且男性、高龄、高血压和糖尿病是中介/高风险独立预测因子(OR=7.812-33.549)。该研究为MASLD患者精准心血管预防提供了重要循证依据。
随着全球肥胖和代谢综合征的流行,代谢相关脂肪性肝病(MASLD)——这个2023年由国际德尔菲共识专家组新命名的疾病——已成为最常见的慢性肝病,全球成人患病率高达32.8%,在肥胖或2型糖尿病(T2DM)人群中甚至超过50%。MASLD不仅本身是肝脏疾病,更是代谢综合征在肝脏的表现,与其驱动因素全身性代谢紊乱紧密相连。更严峻的是,其进展性亚型代谢相关脂肪性肝炎(MASH)占病例的20-30%,推动了肝硬化、肝细胞癌(HCC)和肝相关死亡率不断上升的 morbidity(发病率)。据预测,到2030年,MASLD将超过丙型肝炎和酒精相关性肝病,成为美国肝移植的首要适应症。
然而,真正令临床医生和研究者担忧的是,心血管疾病(CVD)才是MASLD人群死亡的主要原因。胰岛素抵抗、慢性炎症、内皮功能障碍和致动脉粥样硬化性血脂异常等共同通路,构成了MASLD与CVD双向关系的基石。但一个关键问题依然悬而未决:代谢风险因素的数量或类型是否会影响MASLD患者的心血管风险?目前的临床管理缺乏基于代谢负担的清晰风险分层指南,这可能导致高风险个体未能得到及时干预。
为了回答这个问题,一项发表在《European Journal of Medical Research》的研究应运而生。研究人员开展了一项横断面观察性研究,旨在根据MASLD患者所符合的代谢条件数量,对其心血管风险进行分层,从而为临床管理和预防策略提供更清晰的指导。
研究主要采用了以下关键技术方法:研究于2023年1月至2024年1月在埃及Menoufia大学国家肝脏研究所进行,连续入组357名符合2023年国际MASLD共识标准的成年患者。MASLD诊断通过腹部超声证实肝脂肪变性(≥5%肝细胞脂肪堆积)并存在≥1项心脏代谢风险因素(肥胖/BMI≥25 kg/m2、T2DM、或IDF标准的代谢失调)。核心评估包括详细临床指标、肝功能、血脂、糖化血红蛋白(HbA1c)和胰岛素抵抗指数(HOMA-IR、QUICKI)。心血管风险使用美国心脏病学会/美国心脏协会(ACC/AHA)的汇总队列方程计算10年动脉粥样硬化性心血管疾病(ASCVD)风险。患者按代谢标准数量分为三个亚型:亚型1(1个因素)、亚型2(2个因素)、亚型3(3个因素)。统计分析采用SPSS进行组间比较和多元逻辑回归。
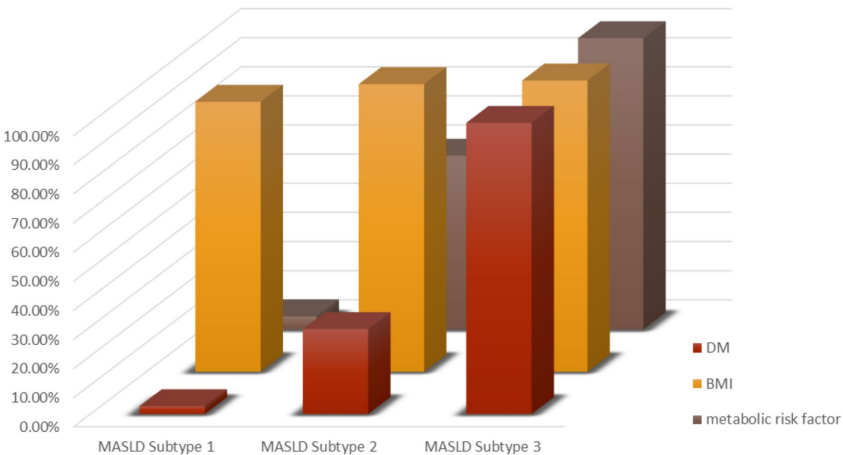
亚型3患者(n=86)年龄显著更大(50.83±9.25岁),高血压患病率最高(43%),而亚型1和亚型2分别为12%和15%(p<0.001)。所有亚型3患者均患有糖尿病和肥胖,100%表现出≥2个代谢风险因素。代谢和血脂参数恶化趋势明显,亚型3的总胆固醇(TC: 256.9±60.27 mg/dL)、低密度脂蛋白(LDL: 170.7±65.41 mg/dL)和甘油三酯(TG: 191.2±63.9 mg/dL)均最高(p<0.001)。10年ASCVD风险评分在亚型3中显著升高(0.112±0.108),远高于亚型1(0.027±0.030)和亚型2(0.052±0.060;p<0.001)。此外,17.4%的亚型3患者被归类为高风险(ASCVD≥20%),而亚型1和亚型2仅分别为2.7%和5.6%(p<0.001)。肝纤维化标志物如FIB-4(1.40±0.78)和NAFLD纤维化评分(NFS: 0.01±1.02)在亚型3中也显著恶化(p<0.001)。
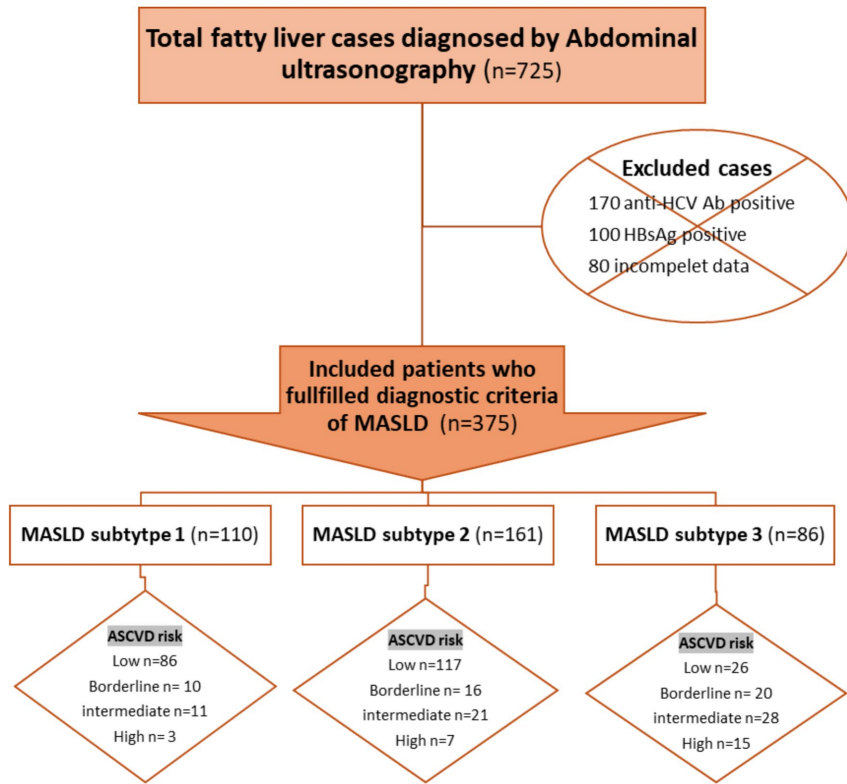
该表进一步强调了亚型3在所有心血管风险参数中的劣势地位,包括更低的HDL(40.10±10.20 mg/dL)和更高的HbA1c(7.80±1.50%),所有比较均具有统计学意义(p<0.001)。
与低风险组(n=250)相比,中介/高风险组(n=107)的患者更可能是男性(63.4% vs. 24.0%)、年龄更大(56.50±9.59 vs. 44.69±9.59岁)、吸烟者(55.5% vs. 44.5%)、患有高血压(39.0% vs. 12.0%)和糖尿病(73.2% vs. 27.3%),所有p值<0.001。他们的LDL(135.20±34.50 vs. 118.30±31.20 mg/dL)、TG(170.40±49.50 vs. 145.60±46.20 mg/dL)和腰臀比(0.95±0.10 vs. 0.90±0.08)也显著更高(p<0.01)。FIB-4评分在中介/高风险组也更高(1.25±0.70 vs. 1.00±0.55, p=0.015)。
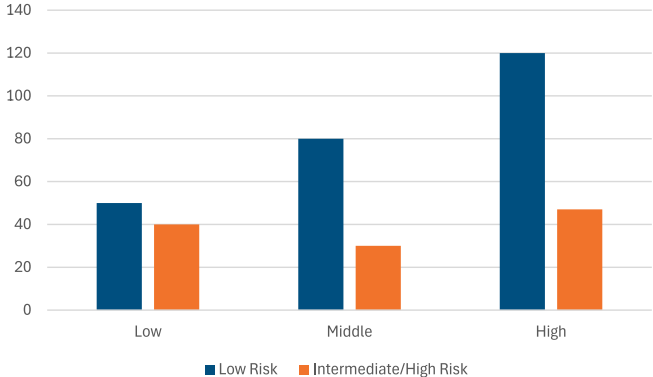
多变量分析确定亚型3是中介/高风险的一个显著独立预测因子(OR=7.812, 95% CI 1.980-30.819, p=0.003)。男性(OR=33.549, 95% CI 11.814-95.269, p<0.001)和年龄增长(OR=1.171, 95% CI 1.116-1.229, p<0.001)也是强有力的预测因子。此外,高血压(OR=9.044)、糖尿病(OR=19.583)、LDL(OR=1.012)和腰臀比(OR=2.166)均被确定为显著独立预测因子(p<0.05)。
这项研究揭示了代谢负担对MASLD患者心血管风险的深远影响,并提供了一个用于风险分层的细致框架。通过根据代谢标准(糖尿病、肥胖和代谢失调)的组合定义三种亚型,研究发现心血管风险呈分级式上升,负担最重的亚型3患者表现出最严重的心脏代谢紊乱和最高的肝纤维化指标。
糖尿病和高血压作为代谢功能障碍的关键支柱,是心血管风险升高的有力预测因子。亚型3中糖尿病的普遍存在,以及其与中介至高ASCVD风险的独立关联,证实了糖尿病和肝脂肪变性在加速动脉粥样硬化中的协同作用。高血压和年龄增长进一步放大了这一风险。
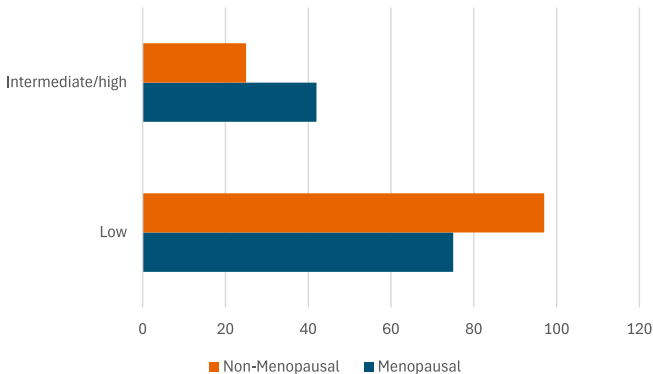
除了代谢负担,激素和生活方式决定因素也可能显著影响MASLD的心血管和肝脏结局。该队列表现出女性为主(66.9%),平均年龄与女性绝经过渡期大量重叠。围绝经期和绝经后的激素变化,特别是雌激素水平下降,与体脂分布、胰岛素抵抗、血脂谱和血管功能的不利变化有关,这可能侵蚀绝经前女性通常观察到的心血管保护优势,从而放大MASLD队列的心血管风险。吸烟是一个额外的加重因素,加速动脉粥样硬化,加剧胰岛素抵抗,并协同恶化代谢性肝病患者的心血管结局。相反,体力活动具有保护作用。
传统肝酶(AST、ALT、GGT)与心血管风险缺乏关联,与代谢参数(如LDL、甘油三酯和腰臀比)的预测能力形成对比,这强化了MASLD作为一种全身性代谢性疾病而非单纯肝脏疾病的身份认同。这一范式转变强调在MASLD管理中优先考虑心脏代谢健康的必要性。
男性、高龄、糖尿病和高血压与心血管风险的强关联呼吁量身定制的筛查策略。男性患者以及患有糖尿病或高血压的患者应优先进行年度心血管评估,包括血脂分析和血压监测。
根据代谢负担对MASLD患者进行分层为临床医生提供了可行的见解。亚型3代表了一个需要积极心血管风险缓解的高风险表型。临床医生应将常规ASCVD风险评估(使用ACC/AHA汇总队列方程等工具)整合到MASLD护理中,特别是对亚型3患者。早期识别这一群体能够实现靶向干预,如强化血糖控制、降脂疗法(如他汀类药物)和抗高血压管理,以预防心血管事件。生活方式改变——包括减肥、规律体力活动和饮食优化(如地中海饮食)——至关重要。这些干预措施不仅针对心血管风险,还可能减轻肝纤维化进展。将绝经状态、戒烟和体力活动评估整合到临床实践中可能因此完善个体化心血管和肝脏风险预测,并指导靶向预防策略。
多学科方法,联合肝病学家、心脏病学家、内分泌学家和营养师,对于提供整体护理至关重要。例如,亚型3患者可能受益于转诊至心脏病学进行高级风险评估(如负荷试验)或转诊至营养师进行个性化饮食计划。这样的协作护理可以优化结局。
该研究存在一些局限性。单中心设计可能限制普适性。横断面设计仅捕获单一时间点的关联,无法推断因果关系。未控制的混杂因素,包括药物使用(如他汀类药物、抗高血压药、抗糖尿病药)和饮食习惯,可能影响观察到的关联。缺乏炎症标志物(如C反应蛋白)或基于影像的评估(如冠状动脉钙化评分、肝脏弹性成像)进一步限制了全面风险分析。虽然当前基于诊断标准累计数量的MASLD亚型分层成功建立了临床相关的代谢功能障碍和心血管风险梯度,但未来的分类将受益于更精细的模型,利用机器学习技术和聚类分析,超越简单计数,识别不同的病理生理内型。未来的研究应解决这些差距以完善风险分层。
总之,根据代谢负担对MASLD患者进行分层能有效识别心血管风险最高的个体。亚型3患者,具有最多代谢异常,表现出显著升高的ASCVD风险和肝纤维化标志物。男性、高龄、绝经、糖尿病和高血压是风险增加的独立预测因子。这些发现支持将心血管筛查整合到MASLD管理中,特别是对于患有晚期代谢功能障碍的患者,以实现更早干预和改善长期结局。
 生物通微信公众号
生物通微信公众号
知名企业招聘