
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:增殖性疣状白斑与侵袭性牙周病原体相关:与口腔扁平苔藓和慢性牙周炎病例的比较研究
【字体: 大 中 小 】 时间:2025年09月24日 来源:Clinical Oral Investigations 3.1
编辑推荐:
本综述深入探讨了增殖性疣状白斑(PVL)这一高恶变潜能的罕见口腔潜在恶性疾患(OPMD),首次通过对比研究揭示其龈下菌斑中红色复合体(如P. gingivalis、T. forsythia)和橙色复合体等侵袭性牙周病原体的丰度显著高于口腔扁平苔藓(OLP)伴剥脱性龈炎(DG)及慢性牙周炎(CP)患者,菌群数量近乎CP患者的三倍。研究强调了牙周病原体作为PVL致病协同因子可能通过慢性炎症及基质金属蛋白酶(MMPs)等机制促进恶性转化(MT),为PVL的临床管理引入了菌斑检测与抗菌治疗新视角。
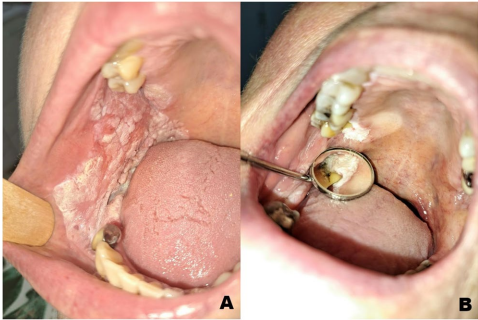
增殖性疣状白斑(Proliferative Verrucous Leukoplakia, PVL)是一种罕见且具有独特临床特征的白斑类型,以口腔黏膜上呈现异质性、疣状白色斑块为主要表现。该病由Hansen于1985年首次描述,其临床进程通常从小的单灶性白斑逐步发展为多灶性病变,具有持续生长和高度的恶变倾向。病变最常见于牙槽黏膜(包括附着龈和游离龈)以及舌部,较少见于口底、腭部或颊黏膜。Silverman曾描述了一种仅累及牙龈表面的亚型,称为牙龈PVL。PVL的鉴别诊断包括口腔扁平苔藓(Oral Lichen Planus, OLP)、创伤性过度角化、牙槽嵴角化症、单灶性上皮异型增生和慢性增生性念珠菌病。
PVL的平均发病年龄为66.8岁,女性患者占明显优势(男女比例约为2.72:1)。组织病理学检查显示其存在过度角化、增生、棘皮症、DNA非整倍性以及基底膜附近的淋巴细胞浸润。晚期病变表现为疣状表面,其异型增生谱系可从无异型增生的上皮增生到轻度乃至重度异型增生,最终发展为明显的口腔癌。病变对摩擦、创伤或局部药物均无反应。
PVL的病因至今未明。Hansen曾将其与吸烟联系起来,但后续研究发现其也发生于非吸烟者。虽然人乳头瘤病毒(HPV)曾被怀疑是PVL的诱因,但活检中并未频繁证实其存在。一些研究报告称活检中可见较高比例的念珠菌菌丝,但这一特征很可能是继发污染所致。
PVL病例通过临床-组织病理学相关性并依据特定标准进行确诊。Cerero-Lapiedra制定的诊断标准分为五项主要标准和四项次要标准。要确诊PVL,病变必须满足三项主要标准(其中组织病理学兼容性是强制性的)或两项主要标准加两项次要标准。
PVL恶变为口腔鳞状细胞癌(Oral Squamous Cell Carcinoma, OSCC)的中位时间为6年。牙龈PVL可转变为OSCC或疣状癌。其总体恶变率超过50%,年恶变率高达10%,其行为显著比普通白斑(恶变率0.13%至17.5%)更为激进。
PVL被世界卫生组织(WHO)列为口腔潜在恶性疾患(Oral Potentially Malignant Disorders, OPMDs)之一,并且是所有OPMD中恶变比例最高的,其次是红斑病。PVL最常见的恶变部位是牙龈和腭部。
尽管已尝试多种治疗方法,但均未取得持久成功。手术切除常与激光消融结合使用;然而,通常更倾向于使用手术刀切除,因为这样可以更准确地对活检标本进行组织病理学评估。Hansen还探索了放疗和化疗的使用,但效果并不一致或持续。广泛的手术切除通常保留给已发生恶变的病例。
对于侵袭性病例,由于病变的进行性性质,密切监测(包括频繁的随访和重复活检)至关重要。即使没有复发的患者也应安排每半年一次的门诊复查。
当前诊断和治疗焦点之外的是PVL病变邻近组织的状况。牙周组织不仅紧邻牙龈表面,而且与舌缘和颊黏膜的边缘相邻。虽然龈下微生物组的复杂性已被认识数十年,但直到最近,侵袭性牙周病原体及其与邻近和远处器官相互作用的复杂关系才受到更广泛的关注。
本研究的时间跨度为2012年至2025年,地点为皮尔森牙科诊所。共诊断和治疗了76例PVL病例,平均随访时间为83个月(7年)。
纳入标准: PVL病例均根据Cerero-Lapiedra标准通过临床和活检证实。这些标准分为主要和次要,并一致应用于所有PVL病例。为达到纳入阈值,患者需要满足至少3项主要标准(平均满足4.02项)或两项主要标准加两项次要标准(平均满足2.5项次要标准)。所有患者均未使用抗生素(ATBs),且过去三个月内未进行牙周 flap 手术。OLP病例仅包括那些经活检和直接免疫荧光证实伴有剥脱性龈炎(Desquamative Gingivitis, DG)的病例。慢性牙周炎(Chronic Periodontitis, CP)病例通过临床探诊(发现真性牙周袋)和骨吸收的影像学分析 verified。只有与PVL组在年龄和性别上匹配的OLP和CP病例才被纳入。比较研究仅包括牙周损伤评估为中度慢性牙周炎(1999年分类)或根据2017年分类为III期B级牙周炎的PVL、OLP和CP病例。中度慢性牙周炎是指结缔组织和骨丧失伴真性牙周袋深度在4至6毫米之间。III期牙周炎涉及牙周袋深度≥6毫米,可能因牙周炎缺失≤4颗牙,垂直骨丧失≥3毫米,可能发生根分叉病变(可达III类,探针可贯通)。B级牙周炎意味着疾病进展速度中等,5年内附着丧失<2毫米。
排除标准: 未满足Cerero-Lipiedra标准的疑似PVL病例被排除。伴有非中度慢性牙周炎的PVL病例被排除。未经组织学证实的OLP病例被排除。患有急性坏死性溃疡性龈炎或当前呈现牙周脓肿的患者也被排除。过去三个月内使用过抗生素或进行过牙周 flap 手术的患者被排除。牙周状态非中度慢性/III期/B级的PVL、OLP或CP病例被排除。以往的侵袭性牙周炎(现称为C级牙周炎,常与伴放线聚集杆菌(Aggregatibacter actinomycetemcomitans, A. actinomycetemcomitans)相关)病例,若经DNA检测 verified 该菌存在,则被排除。所有无牙颌患者的PVL和OLP病例被排除。最后,经 verified 的OLP或牙周炎病例若在年龄和性别上与PVL组不匹配,也被排除。
共有38例初步诊断为PVL的患者因缺乏随访、近期使用抗生素或牙周状态不符合纳入标准而被排除在本比较研究之外。
PVL和OLP病例通过常规活检诊断。当怀疑真菌感染时,采用额外的染色方法,如过碘酸希夫(PAS)染色或Grocotts methenamine silver染色。在OLP病例中,采用直接免疫荧光法检测基底膜沿线的纤维蛋白原沉积。剥脱性龈炎(OLP的特征性牙龈表现)可为广泛性或局限性。它是过度角化、萎缩和由于苔藓样破坏所致糜烂的结合。DG可通过无水肿和充血与CP的临床变化相区分。
PVL病例构成第1组(G1)。第2组(G2)和第3组(G3)包含数量相等的患者:G2包括患有OLP和剥脱性龈炎的个体,G3包括CP患者。所有研究组均特意使女性患者占优势,以反映PVL和OLP在女性中的较高发病率,单纯CP患者则根据G1、G2进行匹配。
所有参与者都提供了纳入研究和后续治疗的知情同意。队列特征如表2所示。
牙周状况使用WHO牙周探针进行临床评估,并通过 orthopantomography 进行可视化。牙槽骨吸收的评估基于釉质牙骨质界与边缘骨之间的距离大于1毫米且无密质骨。牙齿动度被定期监测。牙周病原体通过其DNA进行鉴定,DNA从每个病例中使用五个无菌纸尖收集的龈下菌斑样本中提取。操作后,将纸尖放入无菌Eppendorf试管中以避免污染。仅分析深度超过5毫米的牙周袋。这些牙周袋的平均深度为5-6毫米。为避免偏倚,所有现存牙齿的探诊均由一位经验丰富的临床医生使用WHO探针完成。
使用VariOr-Dento Plus系统(Gen-Trend Co.)通过相对比例区分12种导致牙槽骨吸收的病原体,并定量其在每微升中的浓度。细菌DNA使用qPCR与TaqMan探针进行检测。DNA探针的灵敏度设置为10。病原体存在的最高比例评分为4,表示牙周附着丧失的高风险,对应病原体计数>106。评分降至1,表示较低的吸收风险,细菌计数约为103。
数据使用SigmaXL软件处理,并采用非参数Kruskal-Wallis方法进行分析。
PVL病变最常见于牙槽嵴,累及牙龈或牙槽黏膜的病例占34%(n=44/129),其次是舌部和颊黏膜的病变,各占20%以上。口底、唇黏膜和腭黏膜的病变罕见,各占不到10%。
非吸烟者占PVL患者的46%(n=35/76)。随访显示,38%的PVL患者发展为癌(n=29/76)。口腔鳞状细胞癌(OSCC)最常见的部位是牙槽嵴,占45%(n=13/29)。
比较研究包括38例诊断为PVL的患者,其中38例根据排除标准(主要原因是缺乏病原体检测)被排除。该研究队列中的男女比例为1.53:1(n=23/15)。PVL患者进行牙周病原体检测时的平均年龄为64.1岁(范围40-85岁)。鉴于大多数患者年龄超过60岁,并且研究组中约40%为男性,因此未评估女性性激素对病理发现发展的影响。
全面的牙周检查的加入改善了观察到的PVL病变位置与牙周吸收分布之间的相关性。这种关系如图2所示。
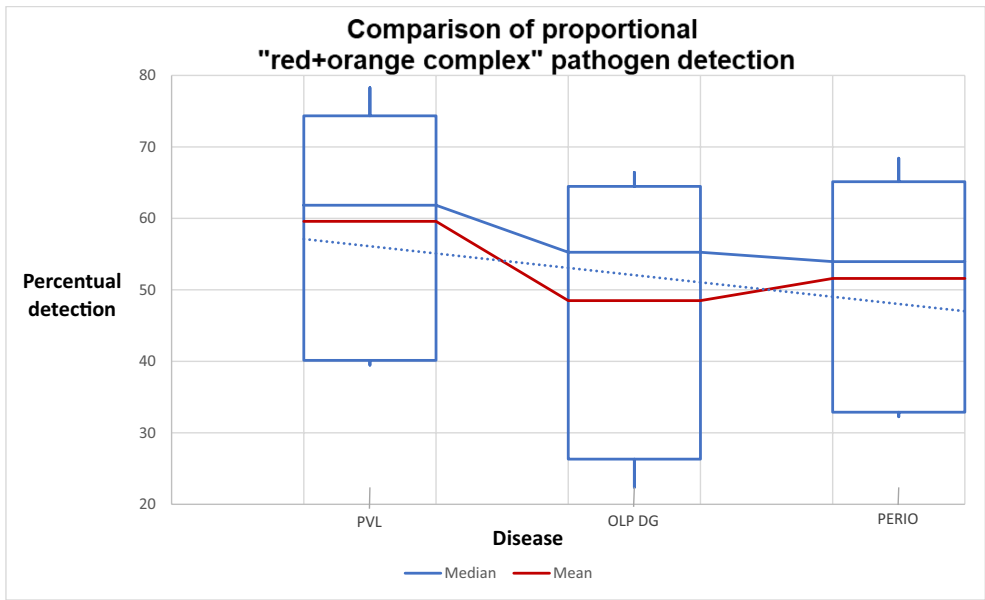
比较了12种检测细菌的比例值及其计数。计算了体积的平均值和中位数。表3展示了红色和橙色复合体病原体的百分比比例比较(最高值以粗体显示)。
我们的研究为PVL发病机制的综合性问题带来了新的见解。据我们所知,这是首个以此为目标 comparative study。与CP相比,侵袭性牙周病原体的三倍增加显著复杂化了PVL病例中的免疫反应。
增殖性疣状白斑(PVL)是一种罕见的口腔潜在恶性疾患(OPMD)的临床形式。它已被纳入WHO从第3版到第5版的OPMD分类中。最新(第5版)于2022年出版,将OPMD分类为包括PVL、白斑、红斑病、口腔上皮异型增生(OED)、HPV相关OED和口腔黏膜下纤维化。
PVL病变通常是特发性的,常为多灶性,并以侵袭性临床行为、高复发率和显著的恶变风险为特征,对治疗管理构成重大挑战。在早期阶段,PVL可能类似于平坦型白斑;组织学上,它可呈现苔藓样浸润,导致可能被误诊为OLP。
虽然PVL历史上与吸烟有关,但多项研究已证实其也发生于非吸烟者。在我们的研究中,46%的患者为非吸烟者(n=35/76)。酒精消费在PVL的发病机制中已被评估,但未发现显著关联;我们队列中没有任何患者被归类为经常性饮酒者。尽管讨论了与HPV的潜在关联,但尚未建立 conclusive link。在我们的研究中,只有11%的病例HPV检测呈阳性。念珠菌菌丝的存在被认为是一种继发现象;在我们的队列中,26%的活检对白色念珠菌染色呈阳性。这可能导致诊断不足,在缺乏显著上皮异型性的情况下,PVL可能被误当作慢性增生性念珠菌病进行管理。
PVL病变最常见于牙槽嵴,据报道高达87%的病例。在我们的队列中,分布更广,牙槽受累占34%,其次是舌和颊黏膜。临床进展通常始于单个牙齿的牙龈,并扩散到相邻的牙龈表面、牙槽旁的颊或舌黏膜。这种行为可能反映了由侵袭性牙周细菌驱动的致病过程。因此,PVL的管理不仅应包括定期的临床检查和活检,还应包括牙周评估,因为一些病变在牙周组织中的行为比上皮表面更具侵袭性。
PVL使用Cerero-Lapiedra标准进行诊断,其中一些是主要标准,另一些是次要标准。一些作者提出了这些标准的简化版本,以便经验不足的临床医生更易于使用。然而,过度简化有可能遗漏重要指标——例如女性性别和非吸烟状态——这些在PVL患者中很常见,并且在缺乏经典风险因素的情况下与高MT率相关。应用完整的Cerero-Lapiedra标准有利于早期识别并避免临床低估。鉴于PVL的高进展率为OSCC,其管理应保留给经验丰富的临床医生。
目前,尚无普遍接受的治疗指南能确保PVL的长期疾病控制。方法包括手术、激光消融、光动力疗法、异丙肌苷(Isoprinosine)甚至放化疗。虽然光动力疗法可能成功治疗可见病变,但它不能预防新病变的发展。在我们的研究中,传统手术刀手术仍然是主要方法,辅以激光消融和个体化的抗菌及抗真菌治疗。对于累及牙龈的PVL进展,我们选择将病变软组织的切除与受累牙齿的拔除以及牙槽的彻底刮治相结合,以确保完全去除,包括龈沟上皮。广泛切除保留给 confirmed MT病例。
在超过30名参与者的研究中,PVL的复发率范围从71.2%到100%。我们的复发率为65%(n=49/76),这可能归因于我们激进的手术方法,特别是对于牙龈PVL,其中牙龈和相邻牙齿的切除伴随着手术和异丙肌苷(Isoprinosine)的联合治疗后复发较少。
PVL的恶变率超过50%,显著高于常规白斑(0.13-17.5%)。根据2020年WHO报告,PVL在所有OPMD中表现出最高的MT率。年转化率高达10%,而白斑为1-5%。Hansen等人概述了PVL向OSCC进展的十个阶段;后来的作者通过省略中间阶段将其浓缩为四个。“场癌变”现象在PVL中 frequently observed。PVL中最常见的MT部位是牙龈或腭部;我们的数据部分支持这一点,45%的转化(n=13/29)发生在牙槽嵴,但腭部未发现。额外的MT协同因子可能包括患者高龄和PVL活检中频繁的DNA非整倍性。Meta分析报告称,PVL病例中与OSCC相关的死亡率高达21.29%。在我们的队列中,六名患者(8%)死于PVL相关的OSCC(n=6/76)。已发表研究的平均随访时间为7.8年(范围3.7-11.6);我们的队列平均随访时间为7年。
越来越多的证据支持牙周病原体在局部和远处部位致癌过程中的作用。口腔微生物组失调可能通过慢性炎症和诱变化谢物的产生影响致癌作用。具核梭杆菌(F. nucleatum)常与胰腺癌和结直肠癌相关,促进炎症、细胞增殖和侵袭以及免疫逃避。连翘坦纳菌(T. forsythia)和牙龈卟啉单胞菌(P. gingivalis)与食管癌有关。P. gingivalis不仅增强口腔癌细胞的侵袭性,还有助于化疗耐药性。
牙周细菌的致病性不仅由细菌负荷决定,还由其分泌产物如MMPs决定。MMPs是锌依赖性内肽酶,参与基底膜和细胞外基质的降解,由细菌和宿主组织产生。MMP-9是这些酶中最大的,在肿瘤过程中升高。它降解IV型胶原,并被认为诱导血管生成——这是从异型增生病变发展成OSCC的关键步骤。MMP-9在OSCC患者的唾液样本中升高,并可能作为生物标志物将其与OPMD或健康对照区分开来。它 also represents a potential target for therapeutic intervention。
一个挥之不去的问题仍然是:为什么存在于大多数人口腔中的细菌只在特定情况下促进癌变?最可能的解释涉及宿主-微生物组相互作用以及致病协同因子,如吸烟、免疫抑制或病毒共感染。红色复合体的成员很少在没有共存橙色复合体细菌的情况下被发现。侵袭性牙周生物膜——包括伴放线聚集杆菌、P. gingivalis、T. forsythia、T. denticola、中间普雷沃菌(P. intermedia)和具核梭杆菌——需要联合治疗,包括抗生素,因为这些病原体可以通过侵入邻近组织来逃避标准刮治程序。生物膜形成使细菌耐药性增加 up to 500-fold。在CP中,红色复合体病原体的数量与牙周袋的深度相关。这一因素在我们研究的纳入和排除标准中被仔细考虑,以最小化偏倚。
我们的结果表明,定期牙周检查和对牙槽PVL病例牙周状况恶化的评估可能有助于恶性转化的早期检测。结合抗菌 therapy 和抑制细菌副产物的药物可能会改善治疗结果和预后,因为目前的 therapy largely ineffective 并且MT率仍然高得惊人——高达38%。
这项研究的重要局限性包括PVL病例的稀有性以及频繁需要激进的手术干预,这使治疗结果的评估复杂化,并阻碍了标准化治疗指南的建立。另一个局限性在于在避免偏倚和保持足够病例以获得显著结果之间找到平衡。
我们的研究强调了侵袭性红色和橙色复合体牙周病原体与PVL之间的显著关联。在我们的研究中,PVL病例这些细菌的存在量是对照CP病例的三倍。这些发现表明了一个重要的协同因子在PVL发病机制中。
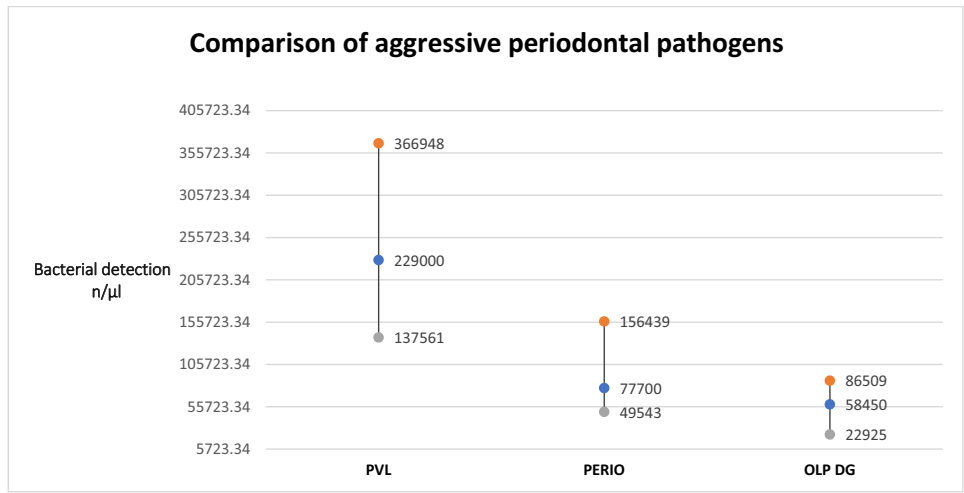
PVL病例在红色和橙色复合体中每种病原体的比例比率、平均和中位数计数以及牙周吸收的风险比率方面均显示出对其他两组的优势。这种差异具有统计学显著性,比例检测的p=0.0009(Kruskal-Wallis检验),置信区间如下:PVL(3-3),牙周炎(2-3),和OLP(2-2)。对于细菌体积(以微升计),统计显著性为p=0.0003(Kruskal-Wallis),置信区间为:PVL(CI:138k-367k),牙周炎(CI:50k-156k),和OLP w/DG(CI:23k-87k)。两次比较的结果如图3和图4所示。
病原体体积的平均比率为PVL:牙周炎:OLP = 2.95:1:0.75,表明PVL病例中侵袭性牙周病原体的存在量几乎是慢性牙周炎的三倍。我们的零假设已被推翻。
常规牙周检查的纳入改善了对牙槽PVL病变的临床管理。即使最初临床稳定的病例,MT的早期检测也变得更为可行。
 生物通微信公众号
生物通微信公众号
知名企业招聘