
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:超越能量:TCA循环代谢物如何在细胞核中调控基因表达与炎症
【字体: 大 中 小 】 时间:2025年09月27日 来源:Journal of Inflammation 4.4
编辑推荐:
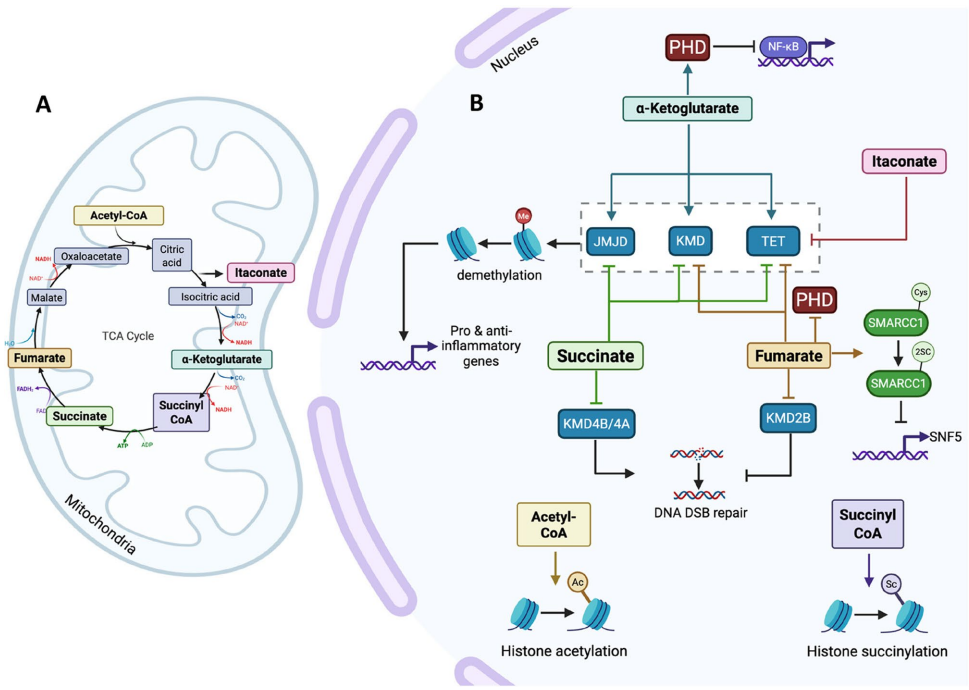
本综述系统阐述了TCA循环代谢物(如乙酰辅酶A、α-酮戊二酸、琥珀酸、富马酸、衣康酸和琥珀酰辅酶A)在细胞核中的非经典功能(moonlighting functions)。这些代谢物通过调控表观遗传修饰(如组蛋白乙酰化/琥珀酰化、DNA甲基化/去甲基化)和染色质重塑,直接参与炎症反应和免疫代谢重编程。文章深入探讨了其在炎症性疾病(如脓毒症、类风湿关节炎)和癌症(如HLRCC、PCC)中的病理机制,为靶向代谢-表观遗传交叉调控的治疗策略提供了重要见解。
 生物通微信公众号
生物通微信公众号
知名企业招聘