
-

生物通官微
陪你抓住生命科技
跳动的脉搏
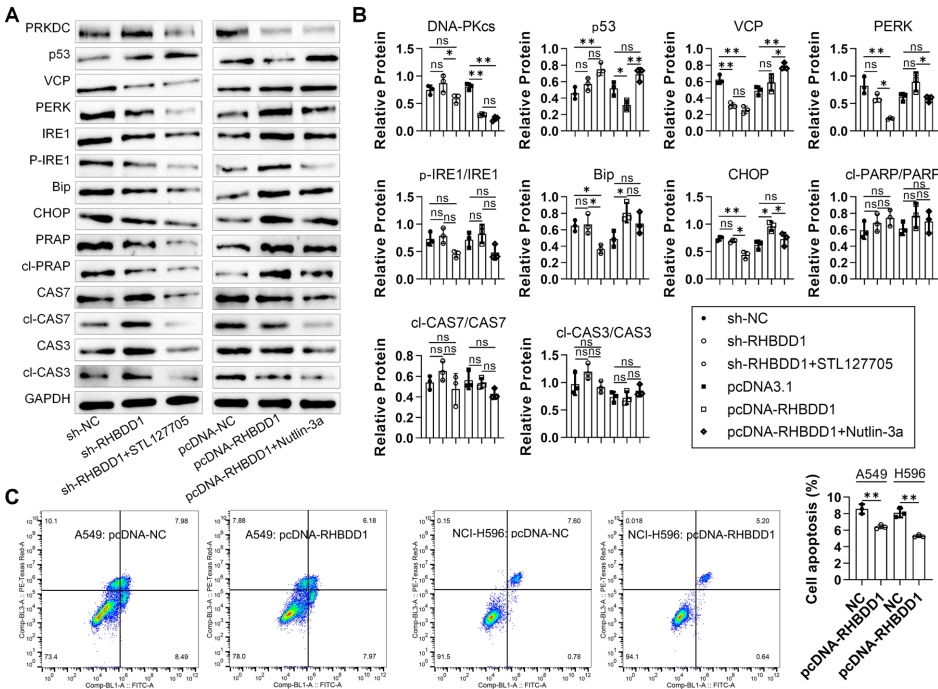
RHBDD1通过内质网相关降解途径调控TP53突变型非小细胞肺癌细胞周期停滞的新机制
【字体: 大 中 小 】 时间:2025年09月27日 来源:European Journal of Medical Research 3.4
编辑推荐:
本研究针对非小细胞肺癌(NSCLC)中TP53突变导致的治疗难题,通过多组学分析和实验验证,首次揭示RHBDD1通过内质网相关降解(ERAD)机制同时降解p53和DNA-PKcs蛋白,诱导TP53突变型NSCLC细胞S期阻滞,但同时抑制DNA-PKcs依赖性凋亡促进细胞存活。该发现为靶向RHBDD1-p53-DNA-PKcs轴治疗TP53突变NSCLC提供了新策略。






 生物通微信公众号
生物通微信公众号
知名企业招聘