
-

生物通官微
陪你抓住生命科技
跳动的脉搏
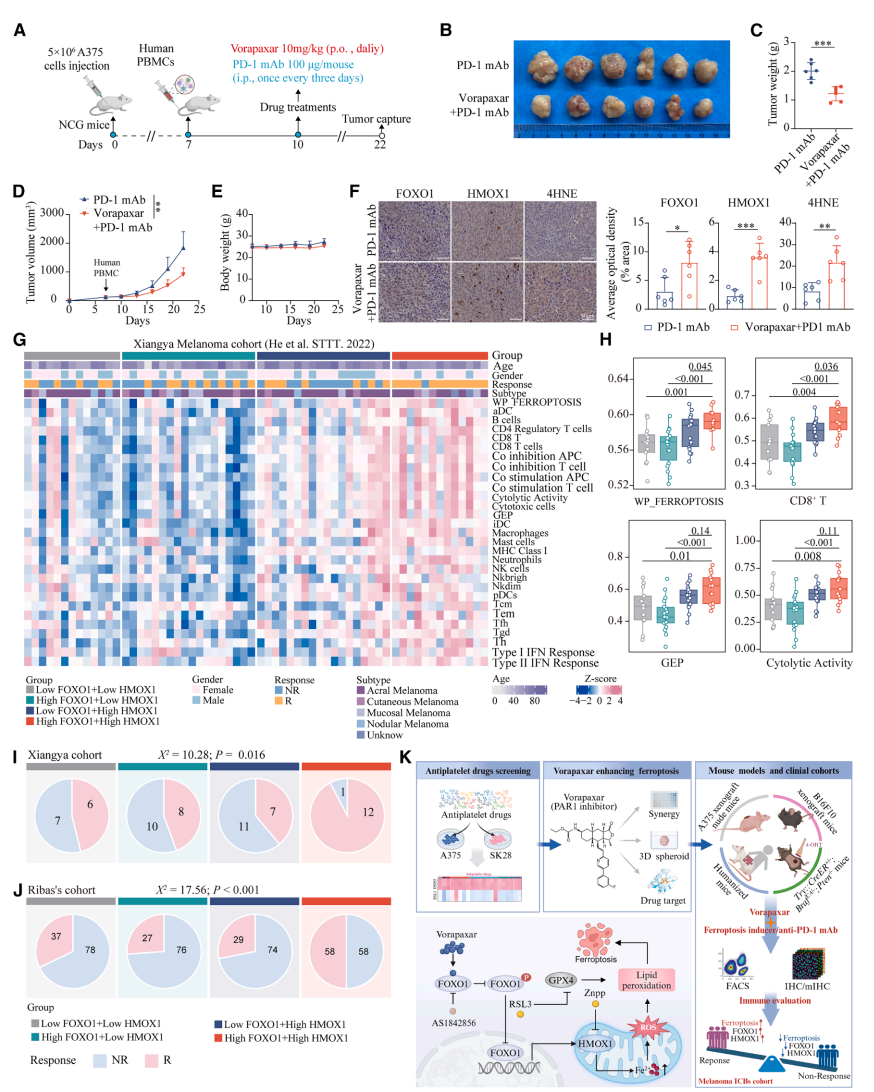
抗血小板药物Vorapaxar通过激活FOXO1/HMOX1轴增强线粒体相关铁死亡以增效癌症免疫治疗
【字体: 大 中 小 】 时间:2025年09月27日 来源:Cell Reports Medicine 10.6
编辑推荐:
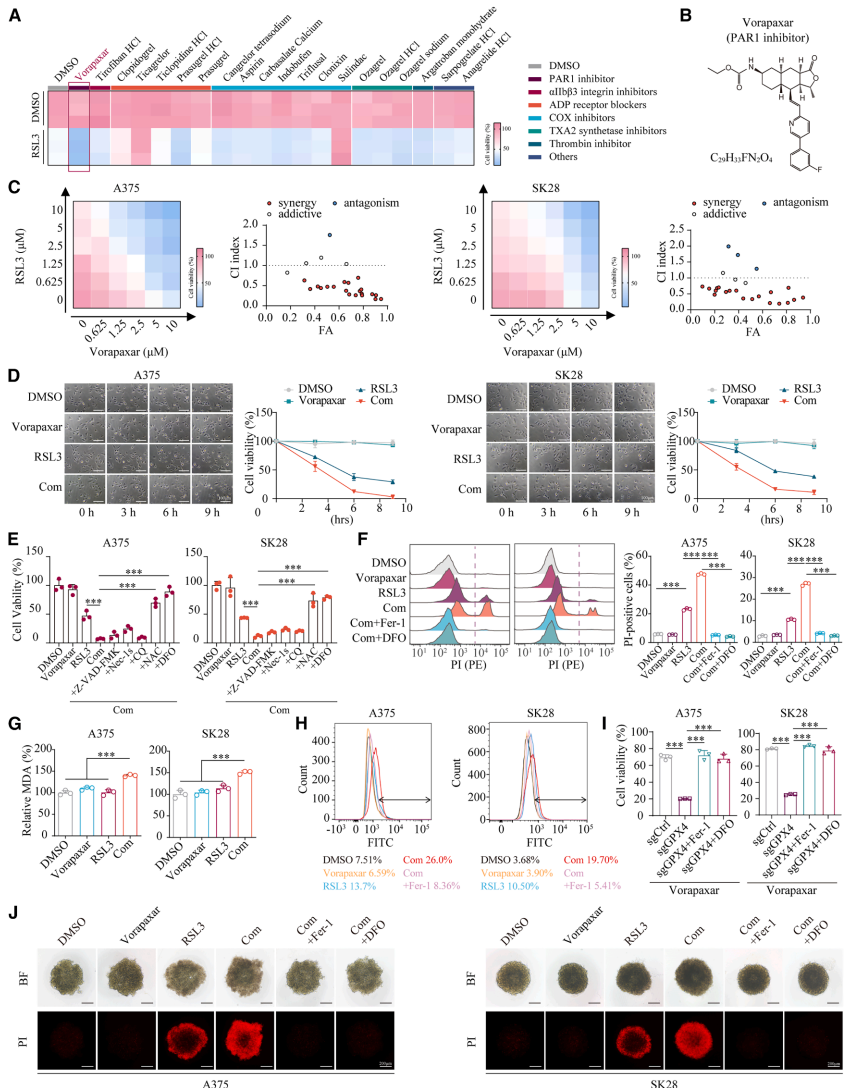
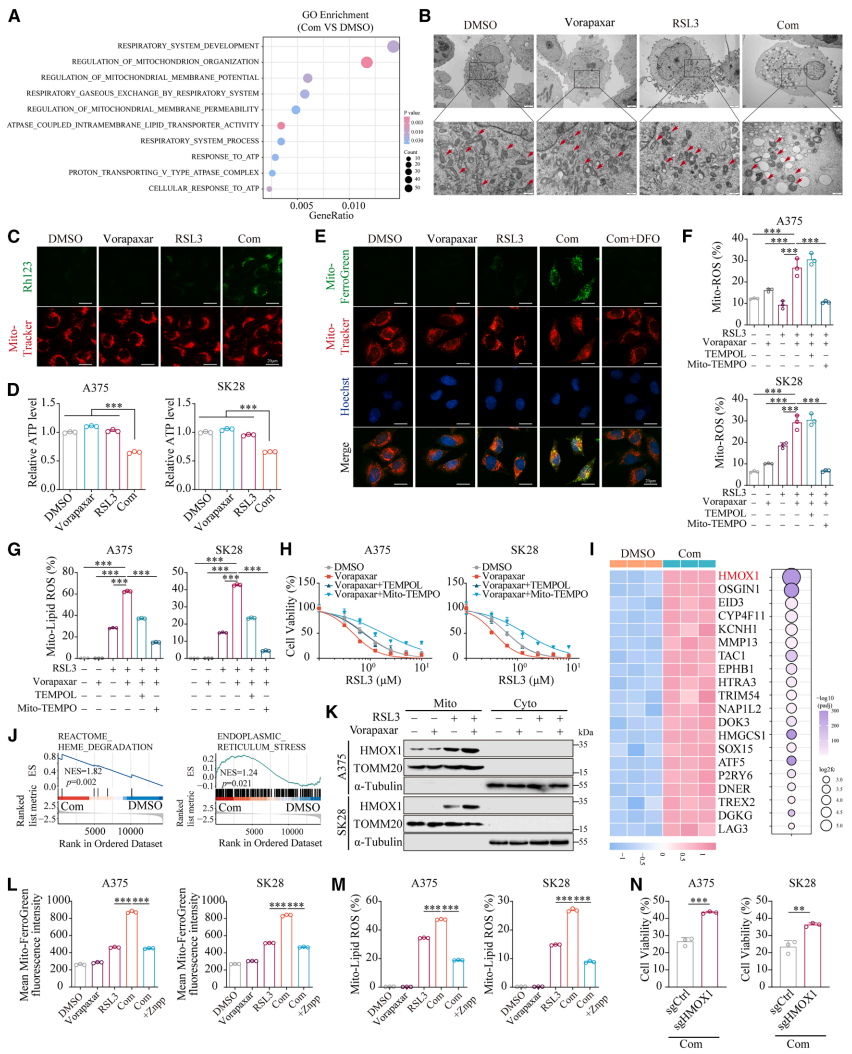
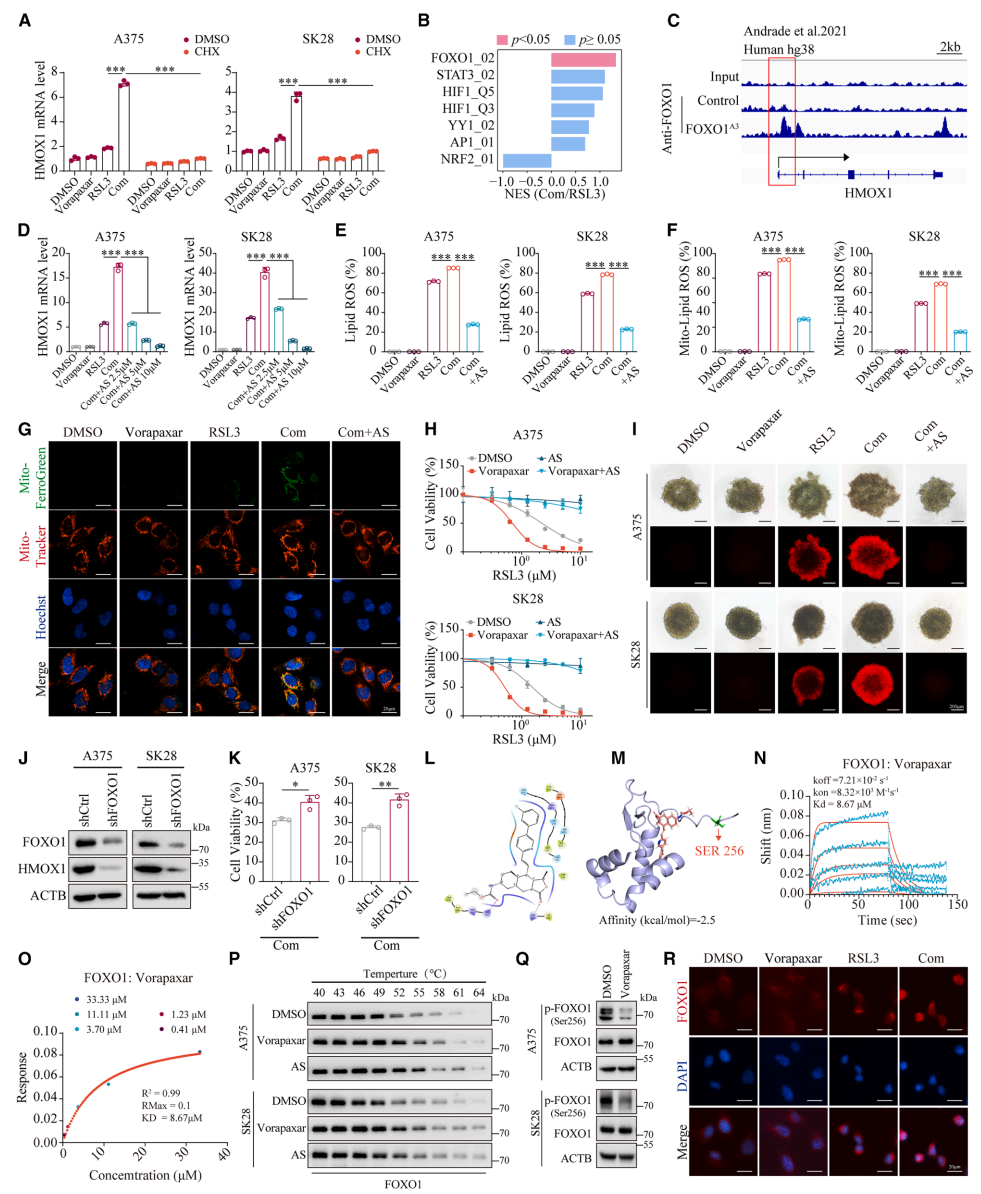
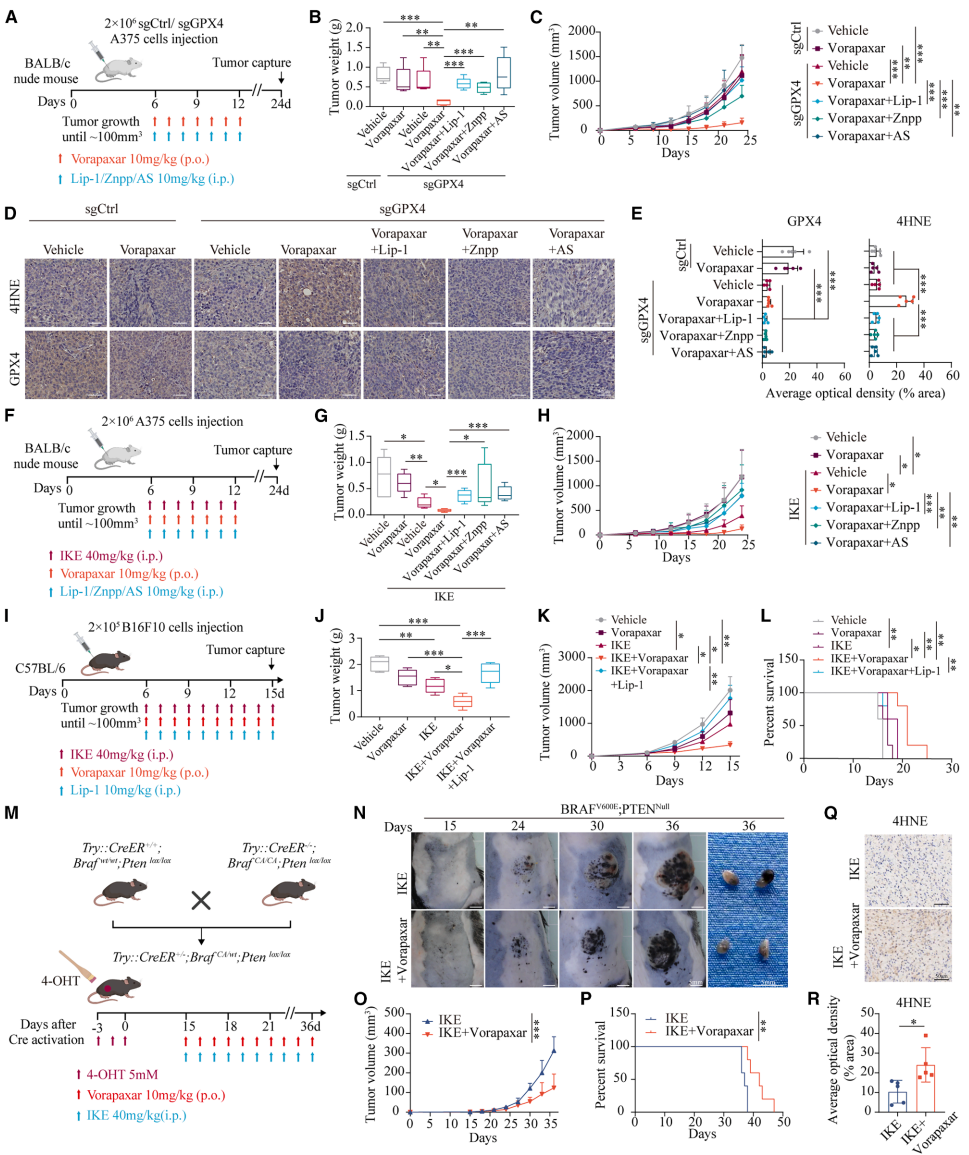
本研究针对免疫治疗抵抗和癌症相关血栓栓塞双重挑战,发现FDA批准的抗血小板药物Vorapaxar可通过直接结合FOXO1、抑制其Ser256位点磷酸化并促进核转位,转录上调HMOX1表达,诱导线粒体铁过载和线粒体相关铁死亡。该机制在黑色素瘤移植模型、自发模型和人源化小鼠模型中均显著增强抗PD-1疗效,且FOXO1/HMOX1高共表达患者呈现更好的免疫治疗应答和生存获益,为兼具抗血栓和增效免疫治疗的双重策略提供新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘